En af de mange fysisk-kemiske processer, der har fundet bred anvendelse, både i industrien og i hverdagen, er elektrolyse - valget på overfladerne af elektroder forbundet med en strømkilde placeret i en opløsning eller smelte, deres komponenter (rent metal - aluminium, kobber, gas osv.). Hovedinstallationen, hvori denne proces finder sted, er en elektrolysator.

Elektrolysator
Hvad er en elektrolyser
En elektrolysator er en speciel installation, der bruges til at adskille dens bestanddele fra en opløsning eller smelte.
De vigtigste egenskaber ved elektrolysatoren er:
- Driftsspændingen for en elektrode varierer fra 1,8 til 2,0 V;
- Strømstyrke - i det normale forløb af elektrolyseprocessen tilføres en strøm til elektroderne med en værdi af denne karakteristik fra 5 til 10 A;
- Antal elektroder - det mindste antal elektroder er 2, det maksimale er begrænset af størrelsen på selve installationen og dens formål;
- Dimensioner på elektroder - ikke kulstænger bruges som elektroder, men metalplader, hvis størrelse bestemmes af formålet med installationen, strømspændingskarakteristikken for strømmen, der tilføres pladerne;
- Afstand mellem modsat ladede elektrodeoverflader - minimumsafstanden mellem elektrodepladerne skal være mindst 1,5 mm;
- Elektrodemateriale - i moderne elektrolysatorer anvendes rustfrit stålplade med nikkel som materiale til anoden og katoden.
En anden vigtig egenskab ved et elektrolyseanlæg er brugen af katalysatorer.
Sådanne installationer bruges til følgende formål:
- Opnåelse af en oxyhydrogengas bestående af en blanding af hydrogen og ilt (Browns gas);
- Isolering af ren aluminium, magnesium, zink fra deres salt smelter;
- Rensning af vand fra salte og urenheder opløst i det;
- Påføring af et tyndt lag nikkel, zink, der forhindrer korrosion på overfladen af metaldele;
- Desinfektion af fødevarer;
- Oprensning af spildevand fra opløste salte af tungmetaller og andre skadelige stoffer.
Vigtig! Platinelektrode fremstillet af almindeligt jern bruges sjældnere i elektrolyseinstallationer end af rustfrit stål, da det oxiderer hurtigere og bliver ubrugeligt.
Selvfremstillet elektrolysator
Alle kan lave en elektrolysator med egne hænder. Til samlingsprocessen af det mest almindelige design er følgende materialer nødvendige:
- rustfrit stålplade (de bedste muligheder er udenlandske AISI 316L eller vores 03X16H15M3);
- bolte М6х150;
- skiver og møtrikker;
- gennemsigtigt rør - du kan bruge et vaterpas, der bruges til konstruktionsformål;
- flere fiskebeslag med en ydre diameter på 8 mm;
- plastbeholder med et volumen på 1,5 liter;
- et lille filter, der filtrerer ledningsvand, for eksempel et filter til vaskemaskiner;
- returventil.
Samlingsproces
Saml elektrolysatoren med dine egne hænder i henhold til følgende instruktioner:
- Først og fremmest skal du markere og den efterfølgende savning af rustfrit stålplade i identiske firkanter. Savning kan udføres med en vinkelsliber (vinkelsliber). Et af hjørnerne i sådanne firkanter skal skæres i en vinkel for at sikre pladerne korrekt;
- Dernæst skal du lave et hul til bolten på siden af pladen modsat hjørnesavskæringen;
- Forbindelsen af pladerne skal ske efter tur: en plade på "+", den næste på "-" og så videre;
- Mellem de forskellige ladede plader skal der være en isolator, der fungerer som et rør fra vaterpas.Det skal skæres i ringe, som skal skæres i længderetningen for at opnå strimler med en tykkelse på 1 mm. Denne afstand mellem pladerne er tilstrækkelig til god gasudvikling under elektrolyse;
- Pladerne fastgøres sammen ved hjælp af skiver som følger: en skive sidder på bolten, derefter en plade, derefter tre skiver efter en plade osv. Plader, der er positivt ladede, placeres i et spejlbillede af negativt ladede ark. Dette gør det muligt at forhindre, at de savede kanter berører elektroderne;


Plader af elektrolyseanlægget samlet
- Når du monterer pladerne, skal du isolere dem samtidigt og stramme møtrikkerne;
- Hver plade skal også ringes for at være sikker på, at der ikke er nogen kortslutning;
- Endvidere skal hele samlingen placeres i en plastikæske;
- Derefter er det værd at fremhæve de steder, hvor boltene berører beholderens vægge, hvor du borer to huller. Hvis boltene ikke passer ind i beholderen, skal de skæres med en baufil;
- Derefter strammes boltene med møtrikker og skiver for at stramme strukturen;


Plader anbragt i en plastikbeholder
- Efter de udførte trin skal du lave huller i beholderlåget og indsætte beslagene i dem. Uigennemtrængelighed i dette tilfælde kan sikres ved at forsegle samlingerne med silikonebaserede fugemasser;
- En sikkerhedsventil og et filter i strukturen er placeret ved gasens udløb og fungerer som et middel til at kontrollere overdreven ophobning af gas, hvilket kan føre til dårlige resultater;
- Elektrolyseenheden er samlet.
Den sidste fase er en test, der udføres på en lignende måde:
- fylde beholderen med vand op til mærket for boltene til fastgørelseselementer;
- tilslutning af strøm til enheden
- forbindelse til rørets montering, hvor den modsatte ende sænkes ned i vandet.
Hvis der tilføres installationen en svag strøm, vil frigivelsen af gas gennem røret næsten være umærkelig, men det vil være muligt at se det inde fra elektrolysatoren. Ved at øge vekselstrømmen, tilsætte en alkalisk katalysator til vandet, kan udbyttet af det gasformige stof øges betydeligt.
Den fremstillede elektrolysator er som regel en vigtig del af mange enheder, for eksempel en brænderbrænder.


udseendet af en hydrogenbrænder, hvis basis betragtes som en selvfremstillet elektrolysator
Kendskab til typer, nøglekarakteristika, enhed og funktionsprincip for ioniske installationer, kan du udføre den korrekte samling af en selvfremstillet struktur, som er en fremragende assistent i en række hverdagssituationer: fra svejsning og besparelse af motorkøretøjers brændstofforbrug til funktion af varmesystemer.
Enhed og funktionsprincip
Katode og anode
Det enkleste elektrolyseanlæg består af flere "celler", som hver inkluderer:
- 2 pladeelektroder - katode (negativ) og anode (positiv);
- En gummipakning omkring omkredsen af to tilstødende forskellige elektroder.
De ydre celler er udstyret med specielle rør, hvorigennem de udviklede gasser udledes.
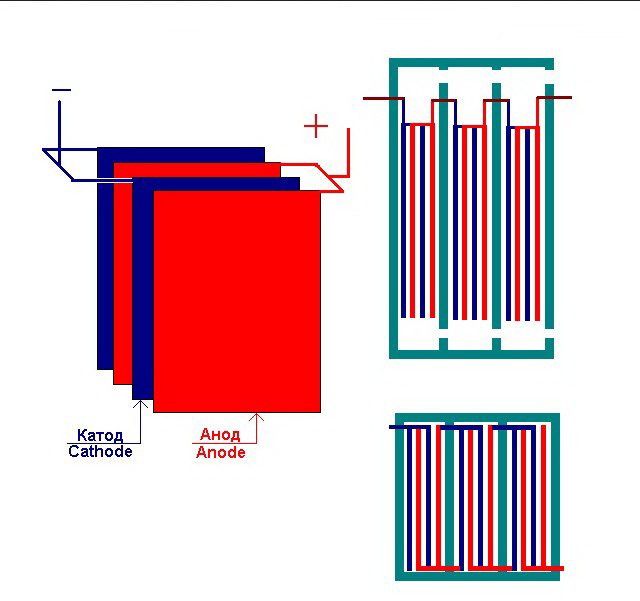

Flere sammenkoblede "celler" i elektrolyseanlægget
Elektrolysatoren kan indeholde fra 1 til 30-40 eller flere sådanne "celler", pladerne med samme navn er forbundet i serie.
Vigtig! Ved anvendelse af strømforsyninger med vekselstrøm anvendes der ligeledes ensrettere, hvoraf den enkleste er en diodebro.
En sådan installation fungerer som følger:
- Destilleret vand med alkali opløst i det eller almindelig bagepulver hældes i rummet mellem elektroderne;
- En spænding på 1,8-2,0 V tilføres fra strømforsyningen til elektroderne i alle celler i installationen;
- Som et resultat af elektrolyseprocessen tiltrækkes anioner (positivt ladede ioner) af et stof opløst i vand til den negativt ladede katode, hvorved der dannes en tynd natriumfilm på den;
- På en positivt ladet anode forekommer ødelæggelsen af vandmolekyler med hver dannet 2 hydrogenatomer og 1 iltatom;
- Den frigivne detonerende gas gennem grenrørene kommer ind i beholderen beregnet til den.
Intensiteten af elektrolyseprocessen afhænger af spændingen og strømstyrken - ved lave værdier af disse egenskaber fortsætter processen ikke. Hvis strømkilden leverer en strøm med for høje værdier af strømspændingskarakteristikken, vil opløsningen, der hældes i elektrolysatoren, være meget varm og koge væk.
Fejlfinding og test af enheden
Derefter er det nødvendigt at bestemme, hvor boltene berører væggene i kassen og på disse steder bore to huller. Hvis det uden nogen åbenbar grund viser sig, at boltene ikke passer ind i beholderen, skal de gøre det klip og stram for at blive tæt med møtrikker... Nu skal du bore dækslet ud og indsætte gevindstikkene der fra begge sider. For at sikre uigennemtrængelighed skal fugen forsegles med et silikonebaseret fugemasse.
Efter at have samlet din egen elektrolysator med dine egne hænder, skal du teste den. For at gøre dette skal du slutte enheden til en strømkilde, fyld den med vand til boltene, sæt på låget ved at forbinde et rør til beslaget og sænke den modsatte ende af røret i vandet. Hvis strømmen er svag, vil strømmen være synlig inde fra elektrolysatoren.
Forøg gradvist strømmen i dit hjemmelavede apparat. Destilleret vand leder ikke elektricitet godt, fordi det ikke indeholder salte eller urenheder. For at forberede elektrolytten er det nødvendigt at tilføje alkali til vandet. For at gøre dette skal du tage natriumhydroxid (indeholdt i rørrensere af typen "mol"). En sikkerhedsventil er nødvendig for at forhindre, at en anstændig mængde gas akkumuleres.
- Det er bedre at bruge destilleret vand og sodavand som katalysator.
- Du skal blande noget bagepulver med fyrre dele vand. Væggene på siderne er bedst lavet af akrylglas.
- Elektroderne er bedst lavet af rustfrit stål. Det giver mening at bruge guld til plader.
- Brug gennemsigtig PVC til bagside. De kan være 200 x 160 millimeter store.
- Du kan bruge din egen elektrolyser, lavet af dig selv, til at tilberede mad til fuldstændig forbrænding af benzin i biler og i de fleste tilfælde.
Tørre elektrolysatorer bruges hovedsageligt til maskiner. Generatoren øger forbrændingsmotorens effekt. Brint antænder meget hurtigere end flydende brændstof, hvilket øger stemplets kraft. Ud over Mole kan du tage Mister Muscle, kaustisk soda, bagepulver.
Generatoren fungerer ikke på drikkevand. Det er bedre at forbinde elektricitet som denne: den første og den sidste plade - minus og på pladen i midten - plus. Jo større areal på pladerne og jo stærkere strøm, jo mere frigives der gas.
Typer af elektrolysatorer
DIY plotsvejsning til batterier
Afhængig af design og driftsprincip er der 5 typer elektrolyseanlæg.
Tør
Disse elektrolysatorer består af pladeelektroder adskilt af forseglede gummipakninger. Ofte placeres "cellerne" i installationen desuden i et lukket kabinet.
Brint og ilt genereret som et resultat af elektrolyse fjernes gennem specielle grenrør placeret i slutningen af kroppen eller de ekstreme plader på installationen.
Flyder
Elektrolyseinstallationer af denne type har følgende anordning:
- Et elektrolysebad (legeme) med to dyser, hvoraf den ene føres elektrolyt ind i det, gennem det andet udledes den detonerende gas dannet som et resultat af elektrolyse;
- Pladeelektroder adskilt af afstandsstykker;
- En tank med elektrolyt placeret over huset med elektroder og forbundet med slanger til grenrørene i installationens elektrolysebad og med et grenrør med en gasventil i den øverste del.
Under driften af en sådan indretning trænger den udviklede gas gennem forgreningsrøret og slangen ind i tanken med elektrolytten og skaber et vist tryk i den og forlader installationen gennem ventilen på forgreningsrøret.
Membran
Elektrolysecellerne i sådanne installationer består af to elektroder adskilt af en tynd membran, der tillader elektrolyseprodukter at passere igennem og adskiller elektroderne fra hinanden.
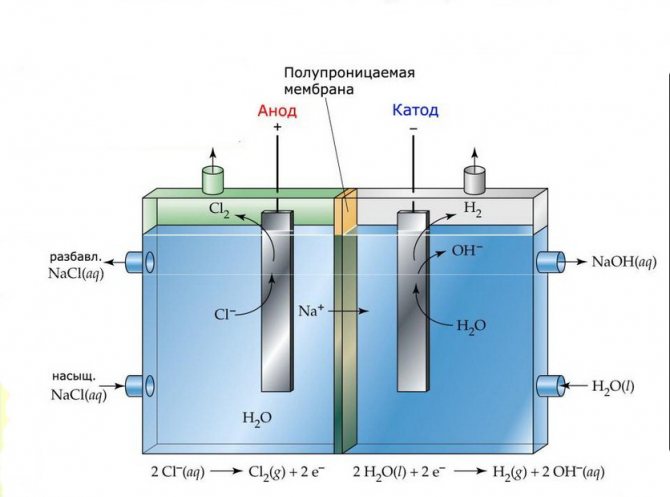

Membranelektrolyseanlæg
Mellemgulv
Elektrolyseinstallationer af denne type består af en "U" -formet kolbe med to elektroder indsat i den og 2-3 uigennemtrængelige membraner. Lignende elektrolysatorer anvendes til separat produktion af rent brint og ilt.
Alkalisk
I modsætning til andre modeller af elektrolysatorer anvendes i disse en alkaliløsning som en elektrolyt - kaustisk soda (natriumhydroxid), som ikke kun er en ekstra kilde til hydrogen og ilt, men også en katalysator til elektrolyse.


Alkalisk elektrolysekredsløb
Sådanne installationer tillader i modsætning til analoger af andre typer brug af billigere elektroder lavet af almindeligt jern.
Gør elektrolysøren med dine egne hænder
Du er helt sikkert bekendt med elektrolyseprocessen fra grundskolens læseplan. Dette er når 2 polære elektroder placeres i vand under strøm for at opnå metaller eller ikke-metaller i deres rene form. En elektrolysator er nødvendig for at nedbryde vandmolekyler i ilt og brint. Elektrolyseren opdeler molekyler i ioner som en del af videnskabelige mekanismer.
Der er to typer af denne enhed:
- Tør elektrolysator (dette er en helt lukket celle);
- Våd elektrolysator (disse er to metalplader anbragt i en vandbeholder).
Denne enhed er enkel med hensyn til enheden, hvilket gør det muligt brug selv derhjemme... Elektrolysatorer opdeler elektrolyseladningerne for molekylernes atomer i ladede atomer.
I vores tilfælde deler det vand i positivt brint og negativt ilt. For at gøre dette kræver en stor mængde energi, og for at gøre mindre af den krævede energi anvendes en katalysator.
Elektrolysator til brintproduktion
Jording beregning
For at samle den enkleste elektrolysator med egne hænder kan du bruge tegningen vist i figuren.


Tegning af den enkleste hjemmelavede elektrolyser
Bemærk! En elektrolysator er en ret farlig installation, som oxyhydrogengas, der akkumulerer i store mængder, under drift kan forårsage en alvorlig eksplosion. Enheden bør ikke placeres i nærheden af kilder til åben ild, varmeenheder.
DIY elektrolyser til en bil
For at forbedre forbrændingen af brændstof i en bilmotor samles der ofte en elektrolysator bestående af en kasse fra et gammelt batteri med rustfri stålplader placeret inde, to dyser, hvoraf den ene er forbundet til en tank fyldt med elektrolyt, den anden er forbundet til en lufttilførselsslange til motoren (mere præcist med en bølgepap fra luftindtaget til luftfilteret).
En sådan hjemmelavet flydende elektrolyser drives af bilens batteri ved hjælp af et relæ og en 10 A sikring.
Vi opretter en enhed med vores egne hænder
Enheden til denne proces kan gøres manuelt.
Til dette skal du bruge:
- Rustfri stålplade;
- Bolte M6 x 150;
- Skiver;
- Nødder;
- Transparent rør;
- Forbindelseselementer med gevind på begge sider;
- En og en halv liter plastbeholder;
- Vandfilter;
- Kontroller ventilen for vand.
En fremragende mulighed for rustfrit stål er AISI 316L fra en udenlandsk producent eller 03X16H15M3 fra en producent fra vores land. Der er absolut ikke behov for at købe rustfrit stål, du kan tage det gamle. 50 til 50 centimeter er nok for dig.
"Hvorfor tage rustfrit stål i sig selv?" - du spørger. Da det mest almindelige metal korroderer. Rustfrit stål tåler alkalier bedre. Skulle gerne skitsere arket på en sådan måde, at det opdeles i 16 lignende firkanter... Du kan skære den med en vinkelsliber. Skær et af hjørnerne i hver firkant.
På den anden side og det modsatte hjørne, fra det savede hjørne, bor et hul til en bolt, der hjælper med at holde pladerne sammen. Elektrolysatoren holder ikke op med at arbejde sådan:t pladens strøm strømmer til pladen - og vand nedbrydes til ilt og brint. Takket være dette har vi brug for en god og negativ plade.
Plader skal tilsluttes skiftevis: plus-minus-plus-minus, med en lignende metode, vil der være en stærk strøm. For at isolere pladerne en fra en anvendes et rør. En ring er skåret fra niveauet. Ved at skære det får vi en stribe millimeter tyk. Denne afstand er mere korrekt til fremstilling af gas.
Pladerne er forbundet med skiver: vi lægger en skive på bolten, derefter en plade og tre skiver, derefter en plade igen og så videre. På plus og minus skal der plantes otte plader. Hvis alt gøres korrekt, vil pladerne ikke røre ved elektroderne.
Derefter skal du stramme møtrikkerne og isolere pladerne. Derefter placerer vi strukturen i en plastikbeholder.
Oversigt over producenter af elektrolysatorer
De største producenter af elektrolysører er begge indenlandske virksomheder (RUSAL, NPF RutTech, JSC Uralkhimmash) såvel som deres udenlandske konkurrenter - Teledyne Energy Systems, Inc (USA), Hydrogenics Corp. (Belgien).
Således er elektrolysatoren en forholdsvis enkel og funktionsrig installation, der bruges til at producere oxyhydrogengas, som i fremtiden er planlagt til at blive brugt som brændstof til forbrændingsmotorer og varmekedler.
Gør-det-selv-hjem-elektrolyse
Da jeg var lille, ville jeg altid gøre noget selv med mine egne hænder. Men forældrene (og andre nære mennesker) tillod i de fleste tilfælde ikke dette. Og jeg så ikke dengang (og indtil nu kan jeg ikke se) noget dårligt, når små børn vil lære ??
Selvfølgelig skrev jeg ikke denne artikel for at huske oplevelser i barndommen i ønsket om at starte selvundervisning. Bare ved et uheld stødte jeg på et spørgsmål af denne art, da jeg surfede på Internettet. En lille bomberdreng stillede spørgsmål om, hvordan man foretager elektrolyse derhjemme. Sandt nok svarede jeg ham ikke, fordi denne dreng ønskede at elektrolysere den smertefulde mistænkelige blanding ?? Jeg besluttede, at jeg ikke ville sige længere ud af synd, lad mig selv se i bøger. Men for ikke så længe siden, igen vandrende gennem fora, så jeg et lignende spørgsmål fra en lærer på en kemiskole. At dømme efter beskrivelsen er hans skole så dårlig, at den ikke kan (ønsker) at købe en elektrolysator til 300 rubler. Læreren (hvilket problem!) Kunne ikke finde en vej ud af den resulterende situation. Så jeg hjalp ham. For dem der er nysgerrige efter denne slags hjemmelavede produkter, sender jeg denne artikel på webstedet.
Faktisk er produktionsprocessen og brugen af vores selvpaller meget primitiv. Men jeg vil fortælle dig om sikkerhed først og om produktion - i det andet. Og pointen er, at vi taler om en demonstrationselektrolysator og ikke om et industrianlæg. Takket være dette vil det for sikkerheden være godt at strømforsyne det ikke fra netværket, men fra AA-batterier eller fra et batteri. Jo højere spænding, jo hurtigere vil elektrolyseprocessen gå. Men for visuel observation af gasbobler er det ret nok 6 V., men 220 er allerede overdreven. med en sådan spænding vil vand for eksempel koge hurtigst, og det er ikke særlig sikkert ... Nå, jeg tror du har fundet ud af spændingen?
Lad os nu tale om, hvor og under hvilke betingelser vi vil eksperimentere. Den allerførste ting, det skal enten være ledig plads eller et godt ventileret rum. Selvom jeg gjorde alt i en lejlighed med lukkede vinduer og intet lignende? For det andet udføres eksperimentet bedst på et godt bord. Ordet "godt" betyder, at bordet skal være stabilt og bedre tungt, stift og fastgjort til gulvoverfladen. I dette tilfælde skal borddækningen være modstandsdygtig over for aggressive stoffer. Forresten er fliser fra en flise perfekte til dette (dog ikke alle, desværre). Et bord som dette vil være nyttigt ikke kun for denne oplevelse. Dog gjorde jeg alt på en almindelig skammel ?? For det tredje behøver du ikke at flytte strømkilden (i mit tilfælde batterier) under eksperimentet. Af hensyn til pålidelighed er det bedst straks at lægge dem på bordet og rette dem, så de ikke springer ud. Tro mig, dette er mere praktisk end at holde dem regelmæssigt med dine hænder. Jeg bandt simpelthen mine egne batterier med elektrisk tape til den første hårde genstand, jeg så. For det fjerde skal de retter, vi vil eksperimentere med, lade dem være små. Et simpelt glas passer eller et skudglas. Forresten er dette den mest optimale måde at bruge briller derhjemme i modsætning til at hælde alkohol i dem med yderligere brug ...
Nå, lad os nu gå specifikt videre til enheden. Det er angivet i figuren, men indtil videre vil jeg kort forklare hvad og hvad.
Vi er nødt til at tage en simpel blyant og fjerne træet fra den med en almindelig kniv og få en hel bly ud af blyanten. Du kan dog tage en føring fra en mekanisk blyant. Men der er to vanskeligheder på én gang. Den første er den sædvanlige. Ledningen fra en mekanisk blyant er for tynd, for os er dette simpelthen ikke egnet til et visuelt eksperiment. Den anden vanskelighed er en eller anden uforståelig sammensætning af de nuværende skifer. Det føles som om de ikke er lavet af grafit, men af noget andet. Generelt var min erfaring med sådan en "bly" slet ikke en succes, selv med en spænding på 24 V. Takket være dette havde jeg brug for at vælge en god woody simpel blyant. Den resulterende grafitstang vil fungere som en elektrode for os. Som du kan forestille dig, har vi brug for to elektroder. Takket være dette vælger vi den anden blyant eller blot bryder den eksisterende stang i to. Jeg gjorde det faktisk.
Med enhver ledning, der kommer i hånden, pakker vi den første blyelektrode (med den ene ende af ledningen), og vi forbinder denne ledning til minus af strømkilden (med den anden ende). Så tager vi anden ledelse og gør det samme med det. Til dette, baseret på dette, har vi brug for en anden ledning. Men i dette tilfælde forbinder vi denne ledning til strømforsyningens plus. Hvis du har problemer med at fastgøre den skrøbelige grafitstang til ledningen, kan du bruge værktøjerne ved hånden, såsom tape eller tape. Hvis det ikke fungerede at pakke spidsen af grafitten med selve ledningen, og båndet eller isoleringstapen ikke gav en tæt kontakt, så prøv at lim ledningen med ledende lim. Hvis du ikke har dette, skal du i det mindste binde ledningen til ledningen med en tråd. Ingen grund til at være bange, tråden brænder ikke ud af en sådan spænding ??
For dem der ikke ved noget om batterier og de enkle regler for tilslutning af dem, vil jeg forklare lidt. Fingerbatteriet producerer en spænding på 1,5 V. På billedet har jeg to lignende batterier. Desuden er de forbundet gradvist - den ene efter den anden, ikke parallelt. Med en lignende (seriel) forbindelse vil den endelige spænding blive opsummeret fra spændingen på hvert batteri, det vil sige for mig er det 1,5 + 1,5 = 3,0 V. Dette er mindre end de tidligere nævnte 6 volt. Men jeg var for doven til at købe et par flere batterier. Princippet dig og så skal være klart ??
Lad os starte eksperimentet. For eksempel vil vi begrænse os til elektrolyse af vand.For det første er den meget tilgængelig (jeg håber, at læseren af denne artikel ikke bor i Sahara), og for det andet er den harmløs. Desuden vil jeg vise, hvordan med den samme enhed (elektrolysator) med det samme stof (vand) kan udføre to forskellige erfaring. Jeg tror, at du har fantasi nok til at komme med en masse lignende eksperimenter med andre stoffer ?? Generelt er ledningsvand egnet til os. Men jeg anbefaler, at du tilføjer lidt mere af det og salter det. En lille smule - det betyder en lille knivspids, ikke en hel dessertske. Dette er vigtigt! Rør saltet godt for at opløse det. Så vand, der er et dielektrikum i ren tilstand, vil perfekt lede elektricitet. i begyndelsen af eksperimentet skal du tørre bordet af potentiel fugt og derefter sætte strømkilden og et glas vand på det.
Vi sænker begge elektroder, der er til stede under spænding, ned i vandet. På samme tid skal du sørge for, at kun grafit nedsænkes i vandet, og at selve ledningen ikke skal røre ved vandet. Begyndelsen af eksperimentet kan blive forsinket. Tiden afhænger af mange indikatorer: af sammensætningen af vandet, ledningernes kvalitet, grafitkvaliteten og selvfølgelig strømkildens spænding. Begyndelsen på min reaktion blev forsinket i et par sekunder. Oxygen begynder at udvikle sig på elektroden, der var forbundet med plus af batterierne. Der frigøres brint på elektroden, der er tilsluttet minus. Det skal bemærkes, at der er flere hydrogenbobler. Meget små bobler sidder fast omkring den del af grafitten, der er nedsænket i vandet. Så begynder nogle af boblene at flyde.
Elektrode i begyndelsen af eksperimentet. Der er ingen gasbobler endnu. Der dannes hydrogenbobler på elektroden, der er forbundet med batteriets negative pol
Hvilke andre eksperimenter kan der være? Hvis du allerede har spillet nok med brint og ilt, fortsætter vi med et andet eksperiment. Det er mere interessant, især for hjemmeforskere. Det er interessant, fordi det er muligt ikke kun at se det, men også at lugte det. Tidligere oplevede vi ilt og brint, som efter min mening ikke er særlig spektakulært. Og i et andet eksperiment får vi to stoffer (forresten nyttige i hverdagen). i begyndelsen af eksperimentet skal du stoppe det forrige eksperiment og tørre elektroderne. Tag nu bordsalt (som du normalt bruger i køkkenrummet) og opløs det i vandmassen. I dette tilfælde ikke et lille beløb. Faktisk er en anstændig mængde salt det eneste, der gør den anden oplevelse anderledes end den første. Efter opløsning af saltet kan du straks gentage eksperimentet. Nu finder en anden reaktion sted. På en god elektrode frigøres det ikke ilt nu, men klor. Og negativt frigøres også brint. Hvad angår glasset, hvor saltopløsningen er placeret, forbliver natriumhydroxid i den efter langvarig elektrolyse. Dette er den velkendte kaustisk soda, alkali.
Klor, du kan lugte det. Men for den bedste effekt anbefaler jeg, at du tager en spænding på mindst 12 V. Ellers føler du måske ikke aromaen. Tilstedeværelsen af alkali (efter en meget lang elektrolyse) i glasset kan kontrolleres på flere måder. Det enkleste og mest voldelige er at lægge hånden i glasset. En etnisk varsel siger, at hvis en brændende fornemmelse begynder, er der alkali i glasset. En smartere og mere tydelig måde er lakmusprøven. Hvis din skole er så fattig, at den ikke engang er i stand til at erhverve en lakmus, vil du blive hjulpet af praktiske indikatorer. En af disse kan, som de siger, tjene som en dråbe roesaft ?? Men det er meget muligt bare at dryppe lidt fedt i løsningen. Så vidt jeg ved, skulle forsæbning finde sted.
For de meget nysgerrige vil jeg beskrive, hvad der faktisk skete under eksperimenterne. I det første eksperiment, under påvirkning af en elektrisk strøm, fandt en lignende reaktion sted: 2 H2O >>> 2 H2 + O2 Begge gasser flyder naturligt fra vandet til overfladen. Forresten kan flydende gasser fanges. Vil du være i stand til at gøre det selv?
I et andet eksperiment var reaktionen helt anderledes.Det blev også initieret af en elektrisk strøm, men nu fungerede ikke kun vand, men også salt som reagenser: 4H2O + 4NaCl >>> 4NaOH + 2H2 + 2Cl2 Husk, at reaktionen skal finde sted i et overskud af vand. For at finde ud af, hvilken mængde salt der betragtes som den største, kan du tælle det fra ovenstående reaktion. Du kan stadig tænke over, hvordan du forbedrer enheden, eller hvilke andre eksperimenter der kan udføres. Det er faktisk muligt, at natriumhypochlorit kan opnås ved elektrolyse. Under laboratorieforhold opnås det i de fleste tilfælde ved at føre gasformigt chlor gennem en natriumhydroxidopløsning.