Един от многото физикохимични процеси, намерили широко приложение, както в промишлеността, така и в ежедневието, е електролизата - изборът върху повърхностите на електродите, свързани към източник на ток, поставен в разтвор или стопилка, техните компоненти (чист метал - алуминий, мед, газ и др.). Основната инсталация, в която се извършва този процес, е електролизатор.

Електролизатор
Какво е електролизатор
Електролизаторът е специална инсталация, използвана за отделяне на съставните му части от разтвор или стопилка.
Основните характеристики на електролизатора са:
- Работното напрежение за един електрод варира от 1,8 до 2,0 V;
- Сила на тока - за нормалния ход на процеса на електролиза към електродите се подава ток със стойност на тази характеристика от 5 до 10 A;
- Брой електроди - минималният брой електроди е 2, максималният е ограничен от размера на самата инсталация и нейното предназначение;
- Размери на електродите - като електроди се използват не въглеродни пръти, а метални пластини, чийто размер се определя от целта на инсталацията, характеристиката на тока и напрежението на тока, подаван към плочите;
- Разстояние между противоположно заредените повърхности на електродите - минималното разстояние между плочите на електродите трябва да бъде най-малко 1,5 mm;
- Електроден материал - в съвременните електролизатори като материал за анода и катода се използва лист от неръждаема стомана с никел.
Друга важна характеристика на електролизата е използването на катализатори.
Такива инсталации се използват за следните цели:
- Получаване на газ оксиводород, състоящ се от смес от водород и кислород (газ на Браун);
- Изолиране на чист алуминий, магнезий, цинк от техните солни стопилки;
- Пречистване на вода от соли и примеси, разтворени в нея;
- Нанасяне на тънък слой никел, цинк, който предотвратява корозията върху повърхността на металните части;
- Дезинфекция на хранителни продукти;
- Пречистване на отпадъчни води от разтворени соли на тежки метали и други вредни вещества.
Важно! Платиновият електрод, направен от обикновено желязо, се използва по-рядко в електролизни инсталации, отколкото от неръждаема стомана, тъй като по-бързо се окислява и става неизползваем.
Самоизработен електролизатор
Всеки може да направи електролизатор със собствените си ръце. За процеса на сглобяване на най-често срещания дизайн ще са необходими следните материали:
- лист от неръждаема стомана (най-добрите варианти са чуждестранни AISI 316L или нашите 03X16H15M3);
- болтове М6х150;
- шайби и гайки;
- прозрачна тръба - можете да използвате нивелир, който се използва за строителни цели;
- няколко фитинги с рибена кост с външен диаметър 8 mm;
- пластмасов контейнер с обем 1,5 литра;
- малък филтър за филтриране на чешмяна вода, например филтър за перални машини;
- възвратен клапан за вода.
Процес на сглобяване
Съберете електролизатора със собствените си ръце, съгласно следните инструкции:
- На първо място, трябва да маркирате и последващото рязане на листа от неръждаема стомана на еднакви квадратчета. Рязането може да се извърши с ъглошлайф (ъглошлайф). Един от ъглите на такива квадрати трябва да бъде изрязан под ъгъл, за да се закрепят правилно плочите;
- След това трябва да направите дупка за болта от страната на плочата, противоположна на ъгловия трион;
- Свързването на плочите трябва да се извършва на свой ред: една плоча на "+", следващата на "-" и така нататък;
- Между различно заредените плочи трябва да има изолатор, който действа като тръба от нивелира.Трябва да се нарязва на пръстени, които да се режат по дължина, за да се получат ленти с дебелина 1 мм. Това разстояние между плочите е достатъчно за добро отделяне на газ по време на електролиза;
- Плочите се закрепват заедно с помощта на шайби, както следва: шайба седи върху болта, след това плоча, след това три шайби, след плоча и т.н. Плочите, благоприятно заредени, се поставят в огледално изображение на отрицателно заредени листове. Това прави възможно предотвратяването на допираните ръбове на електродите;


Плочи на електролизата, сглобени заедно
- Когато сглобявате плочите, трябва едновременно да ги изолирате и да затегнете гайките;
- Също така, всяка плоча трябва да бъде опръстенена, за да е сигурно, че няма късо съединение;
- Освен това целият монтаж трябва да бъде поставен в пластмасова кутия;
- След това си струва да подчертаете местата, където болтовете докосват стените на контейнера, където пробивате две дупки. Ако болтовете не се вписват в контейнера, тогава те трябва да се режат с ножовка;
- След това болтовете се затягат с гайки и шайби за плътност на конструкцията;


Плочи, поставени в пластмасов контейнер
- След предприетите стъпки ще трябва да направите дупки в капака на контейнера и да поставите фитингите в тях. Непропускливостта в този случай може да бъде осигурена чрез запечатване на фугите с уплътнители на силиконова основа;
- Предпазен клапан и филтър в конструкцията са разположени на изхода за газ и служат като средство за контрол на прекомерното натрупване на газ, което може да доведе до лоши резултати;
- Устройството за електролиза е сглобено.
Последният етап е тест, който се извършва по подобен начин:
- пълнене на контейнера с вода до маркировката на болтовете за крепежни елементи;
- свързване на захранването към устройството;
- връзка с фитинга на тръбата, противоположният край на която се спуска във водата.
Ако към инсталацията се приложи слаб ток, тогава отделянето на газ през тръбата ще бъде почти незабележимо, но ще бъде възможно да се наблюдава от вътрешността на електролизера. Чрез увеличаване на променливия ток, добавяне на алкален катализатор към водата, добивът на газ може да бъде значително увеличен.
Изработеният електролизатор по правило е важна част от много устройства, например водородна горелка.


появата на водородна горелка, чиято основа се счита за самоизработен електролизатор
Познавайки видовете, ключовите характеристики, устройството и принципа на работа на йонните инсталации, можете да извършите правилния монтаж на самоизработена конструкция, която е отличен помощник в различни ежедневни ситуации: от заваряване и спестяване на разход на гориво на моторни превозни средства до функционирането на отоплителните системи.
Устройство и принцип на действие
Катод и анод
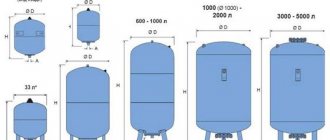
Най-простата електролиза се състои от няколко "клетки", всяка от които включва:
- 2 плоча електроди - катод (отрицателен) и анод (положителен);
- Гумено уплътнение по периметъра на два съседни различни електрода.
Външните клетки са оборудвани със специални тръби, през които се отделят отделените газове.
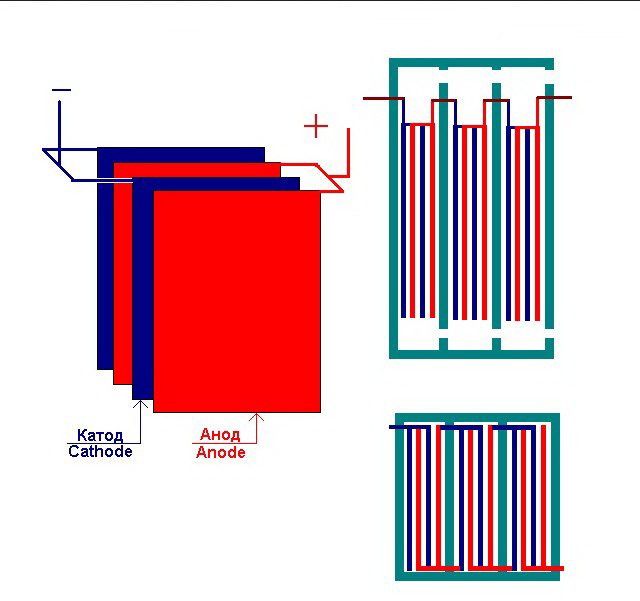

Няколко взаимосвързани "клетки" на електролизата
Електролизаторът може да съдържа от 1 до 30-40 или повече такива "клетки", плочите със същото име са свързани последователно.
Важно! Когато се използват захранващи устройства с променлив ток, допълнително се използват токоизправители, най-простият от които е диоден мост.
Такава инсталация работи по следния начин:
- В пространството между електродите се излива дестилирана вода с разтворени в нея алкали или обикновена сода за хляб;
- Напрежение от 1,8-2,0 V се подава от захранването към електродите на всички клетки на инсталацията;
- В резултат на процеса на електролиза аниони (положително заредени йони) на вещество, разтворено във вода, се привличат към отрицателно заредения катод, в резултат на което върху него се образува тънък натриев филм;
- На положително зареден анод се случва разрушаването на водните молекули, като всеки от тях образува 2 водородни атома и 1 кислороден атом;
- Отделеният детониращ газ през разклонителните тръби влиза в предназначения за него контейнер.
Интензивността на процеса на електролиза зависи от напрежението и силата на тока - при ниски стойности на тези характеристики процесът няма да продължи. Ако източникът на захранване подава ток с твърде високи стойности на характеристиката на токовото напрежение, разтворът, излят в електролизера, ще бъде много горещ и ще заври.
Отстраняване на грешки и тестване на устройството
След това е необходимо да се определи къде болтовете докосват стените на кутията и на тези места пробийте две дупки. Ако без видима причина се окаже, че болтовете не се вписват в контейнера, тогава трябва изрежете и затегнете за плътност с гайки... Сега трябва да пробиете капака и да поставите резбовите съединители там от двете страни. За да се осигури непропускливост, фугата трябва да бъде запечатана с уплътнител на силиконова основа.
След като сглобите собствения си електролизатор със собствените си ръце, трябва да го тествате. За да направите това, свържете устройството към източник на захранване, напълнете го с вода до болтовете, поставете капака, като свържете тръба към фитинга и спуснете противоположния край на тръбата във водата. Ако токът е слаб, тогава токът ще се вижда от вътрешността на електролизера.
Постепенно увеличавайте тока във вашия домашен уред. Дестилираната вода не води добре електричеството, тъй като не съдържа соли или примеси. За да приготвите електролита, е необходимо да добавите алкали към водата. За да направите това, трябва да вземете натриев хидроксид (съдържащ се в средства за почистване на тръби като "Mole"). Необходим е предпазен клапан, за да се предотврати натрупването на прилично количество газ.
- По-добре е да използвате дестилирана вода и сода като катализатор.
- Трябва да смесите част от содата за хляб с четиридесет части вода. Стените отстрани са най-добре от акрилно стъкло.
- Електродите са най-добре изработени от неръждаема стомана. Има смисъл да се използва злато за чинии.
- Използвайте полупрозрачен PVC за подложка. Те могат да бъдат с размери 200 на 160 милиметра.
- Можете да използвате свой собствен електролизатор, направен от вас сами, за готвене на храна, за пълно изгаряне на бензин в автомобилите и в повечето случаи.
Сухите електролизатори се използват главно за машини. Генераторът увеличава мощността на двигателя с вътрешно горене. Водородът се запалва много по-бързо от течното гориво, увеличавайки силата на буталото. В допълнение към Mole можете да приемате Mister Muscle, сода каустик, сода бикарбонат.
Генераторът не работи на питейна вода. По-добре е да свържете електричество по този начин: първата и последната плоча - минус, а на плочата в средата - плюс. Колкото по-голяма е площта на плочите и колкото по-силен е токът, толкова повече газ се отделя.
Видове електролизатори
Направи си сам точково заваряване за батерии
В зависимост от дизайна и принципа на действие има 5 вида електролизни инсталации.
Суха
Тези електролизатори се състоят от пластинчати електроди, разделени от уплътнени гумени уплътнения. Често "клетките" на инсталацията се поставят допълнително в запечатана кутия.
Водородът и кислородът, генерирани в резултат на електролиза, се отстраняват чрез специални разклонителни тръби, разположени в края на тялото или крайните плочи на инсталацията.
Течаща
Инсталациите за електролиза от този тип имат следното устройство:
- Електролизна вана (тяло) с две дюзи, през едната от които в нея се подава електролит, през втората се отвежда детониращият газ, образуван в резултат на електролиза;
- Плочи електроди, разделени с дистанционни елементи;
- Резервоар с електролит, разположен над корпуса с електроди и свързан с маркучи към разклонителните тръби на електролизната баня на инсталацията и имащ разклонителна тръба с газов клапан в горната част.
По време на работата на такова устройство, отделеният газ през разклонителната тръба и маркучът влиза в резервоара с електролита и, създавайки определено налягане в него, напуска инсталацията през клапана на разклонителната тръба.
Мембрана
Клетките за електролиза на такива инсталации се състоят от два електрода, разделени от тънка мембрана, която позволява на продуктите на електролизата да преминат и отделя електродите един от друг.
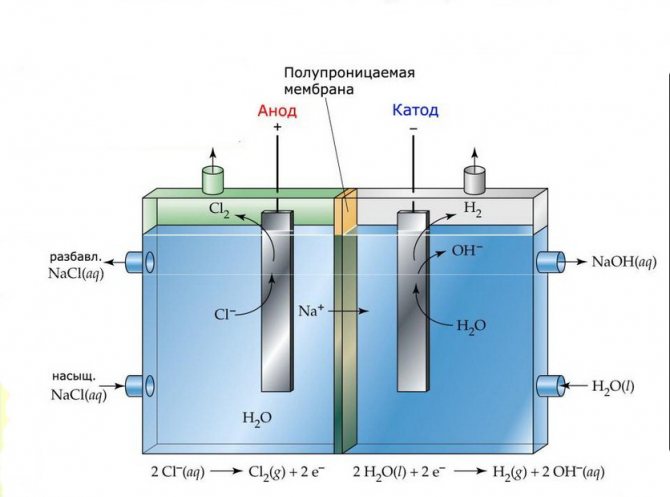

Завод за мембранна електролиза
Мембрана
Инсталациите за електролиза от този тип се състоят от U-образна колба с два вкарани в нея електроди и 2-3 непропускливи диафрагми. Подобни електролизатори се използват за разделно производство на чист водород и кислород.
Алкална
За разлика от други модели електролизатори, в тях алкален разтвор се използва като електролит - сода каустик (натриев хидроксид), която е не само допълнителен източник на водород и кислород, но и катализатор за електролиза.


Алкална електролизерна верига
Такива инсталации, за разлика от аналози от други видове, позволяват използването на по-евтини електроди, изработени от обикновено желязо.
Направете електролизатора със собствените си ръце
Със сигурност сте запознати с процеса на електролиза от учебната програма на началното училище. Това е, когато 2 полярни електроди се поставят във вода под ток, за да се получат метали или неметали в чист вид. Необходим е електролизатор за разлагане на водните молекули в кислород и водород. Електролизаторът, като част от научните механизми, разделя молекулите на йони.
Има два вида това устройство:
- Сух електролизатор (това е напълно затворена клетка);
- Мокър електролизатор (това са две метални пластини, поставени в съд с вода).
Това устройство е просто по отношение на устройството, което го прави възможно използвайте дори у дома... Електролизаторите разделят зарядите за електролиза на атомите на молекулите на заредени атоми.
В нашия случай тя разделя водата на положителен водород и отрицателен кислород. За целта е необходимо голямо количество енергия и за да се направи по-малко от необходимото количество енергия се използва катализатор.
Електролизатор за производство на водород
Изчисляване на заземяването
За да съберете най-простия електролизатор със собствените си ръце, можете да използвате чертежа, показан на фигурата.


Чертеж на най-простия домашен електролизатор
Забележка! Електролизаторът е доста опасна инсталация, която по време на работа газообразният кислород, натрупвайки се в големи количества, може да причини сериозна експлозия. Уредът не трябва да се поставя в близост до източници на открит огън, отоплителни устройства.
Направи си сам електролизатор за кола
За да се подобри изгарянето на гориво в автомобилния двигател, често се сглобява електролизатор, състоящ се от корпус от стара батерия с поставени вътре плочи от неръждаема стомана, две дюзи, едната от които е свързана с резервоар, пълен с електролит, а вторият е свързан с маркуч за подаване на въздух към двигателя (по-точно с гофриран от въздухозаборника към въздушния филтър).
Такъв самоделен течащ електролизатор се захранва от батерията на автомобила с помощта на реле и 10 A предпазител.
Създаваме устройство със собствените си ръце
Устройството за този процес може да се направи на ръка.
За това ще ви трябва:
- Лист от неръждаема стомана;
- Болтове M6 x 150;
- Шайби;
- Ядки;
- Прозрачна тръба;
- Свързващи елементи с резба от двете страни;
- Един и половина литра пластмасов контейнер;
- Воден филтър;
- Обратен клапан за вода.
Отличен вариант за неръждаема стомана е AISI 316L на чуждестранен производител или 03X16H15M3 на производител от нашата страна. Няма абсолютно никаква нужда да купувате неръждаема стомана, можете да вземете старата. 50 до 50 сантиметра са ви достатъчни.
„Защо да вземем самата неръждаема стомана?“ - ти питаш. Тъй като най-често срещаният метал ще корозира. Неръждаемата стомана понася по-добре алкалите. Трябва очертайте листа по такъв начин, че да го разделите на 16 подобни квадрата... Можете да го отрежете с ъглошлайф. Във всеки квадрат изрежете един от ъглите.
От другата страна и срещуположния ъгъл, от изрязания ъгъл, пробийте отвор за болт, който ще ви помогне да държите плочите заедно. Електролизаторът не спира да работи така:t плоча електричество тече към плочата - и водата се разлага на кислород и водород. Благодарение на това се нуждаем от добра и отрицателна плоча.
Плочите трябва да бъдат свързани последователно: плюс-минус-плюс-минус, при подобен метод ще има силно течение. За изолиране на плочите една от една се използва тръба. От нивото се изрязва пръстен. Чрез изрязването му получаваме лента с дебелина милиметър. Това разстояние е по-правилно за направата на газ.
Плочите са свързани помежду си с шайби: поставяме шайба на болта, след това плоча и три шайби, след това отново плоча и т.н. В плюс и минус трябва да бъдат засадени осем плочи. Ако всичко е направено правилно, тогава разрезите на плочите няма да докоснат електродите.
След това трябва да затегнете гайките и да изолирате плочите. След това поставяме конструкцията в пластмасов съд.
Преглед на производителите на електролизатори
Основните производители на електролизатори са както местните предприятия (RUSAL, NPF RutTech, JSC Uralkhimmash), така и техните чуждестранни конкуренти - Teledyne Energy Systems, Inc (САЩ), Hydrogenics Corp. (Белгия).
По този начин електролизаторът е доста проста и богата на функции инсталация, използвана за производство на кислороден газ, който в бъдеще се планира да се използва като гориво за двигатели с вътрешно горене и отоплителни котли.
Направи си сам домашна електролиза
Когато бях малък, винаги съм искал да направя нещо сам, със собствените си ръце. Но родителите (и други близки хора) в повечето случаи не позволяват това. И не видях тогава (и до сега не виждам) нищо лошо, когато малките деца искат да учат ??
Разбира се, не написах тази статия, за да си припомня детските преживявания в желанието да започна самообучение. Съвсем случайно, когато сърфирах в Интернет, попаднах на въпрос от този род. Едно малко момче-бомбардировач зададе въпроси за това как да се направи електролиза у дома. Вярно, не му отговорих, защото това момче искаше да електролизира болезнено подозрителната смес ?? Реших, че няма да казвам по-нататък от грях, нека сам да погледна в книгите. Но не толкова отдавна, отново скитайки из форумите, видях подобен въпрос от учител в химическо училище. Съдейки по описанието, училището му е толкова бедно, че не може (не иска) да си купи електролизатор за 300 рубли.Учителят (какъв проблем!) Не можа да намери изход от създалата се ситуация. Затова му помогнах. За тези, които са любопитни към този вид домашно приготвени продукти, публикувам тази статия на сайта.
Всъщност производственият процес и използването на нашия самопалет са много примитивни. Но за безопасността ще ви кажа първо, а за производството - във второто. И въпросът е, че говорим за демонстрационен електролизатор, а не за промишлено предприятие. Благодарение на това, за безопасност, ще бъде добре да го захранвате не от мрежата, а от AA батерии или от батерия. Естествено, колкото по-високо е напрежението, толкова по-бързо ще протича процесът на електролиза. Въпреки това, за визуално наблюдение на газови мехурчета, това е доста достатъчно 6 V, но 220 вече е прекомерно. при такова напрежение водата например ще ври най-бързо, а това не е много безопасно ... Е, мисля, че разбрахте напрежението?
Сега нека поговорим къде и при какви условия ще експериментираме. Първото нещо, това трябва да бъде или свободно пространство, или добре проветриво помещение. Въпреки че направих всичко в апартамент със затворени прозорци и нищо подобно? Второ, експериментът е най-добре да се направи на добра маса. Думата "добро" означава, че масата трябва да е стабилна и по-тежка, твърда и прикрепена към повърхността на пода. В този случай покритието на масата трябва да е устойчиво на агресивни вещества. Между другото, плочката от плочка е идеална за това (макар и не всяка, за съжаление). Таблица като тази ще бъде полезна не само за това преживяване. Направих обаче всичко на обикновен стол ?? Трето, по време на експеримента не е нужно да премествате източника на захранване (в моя случай батериите). Поради това, за надеждност, най-добре е веднага да ги поставите на масата и да ги фиксирате, така че да не помръднат. Повярвайте ми, това е по-удобно, отколкото да ги държите редовно с ръце. Просто завързах собствените си батерии с електрическа лента за първия твърд обект, който видях. Четвърто, ястията, в които ще експериментираме, нека бъдат малки. Обикновена чаша се вписва или стъклена чаша. Между другото, това е най-оптималният начин за използване на очила у дома, за разлика от изливането на алкохол в тях при по-нататъшна употреба ...
Е, сега да преминем конкретно към устройството. Представено е на фигурата, но засега ще обясня накратко какво и какво.
Трябва да вземем обикновен молив и да премахнем дървото от него с обикновен нож и да извадим цял повод от молива. Можете обаче да поведете от механичен молив. Но има две трудности наведнъж. Първият е обичайният. Поводът от механичен молив е твърде тънък, за нас това просто не е подходящо за визуален експеримент. Втората трудност е някакъв неразбираем състав на сегашните плочи. Изглежда, че те не са направени от графит, а от нещо друго. Като цяло опитът ми с такъв "олово" изобщо не беше успешен дори при напрежение 24 V. Благодарение на това трябваше да избера добър дървесен прост молив. Полученият графитен прът ще ни служи като електрод. Както можете да си представите, ние се нуждаем от два електрода. Благодарение на това отиваме да вземем втория молив или просто да счупим съществуващия прът на две. Всъщност направих това.
С всеки проводник, който дойде под ръка, обвиваме първия оловен електрод (с единия край на проводника) и свързваме този проводник с минуса на източника на захранване (с другия край). След това поемаме второто олово и правим същото с него. За това, въз основа на това, се нуждаем от втори проводник. Но в този случай свързваме този проводник с плюса на захранването. Ако имате проблеми с прикрепването на крехкия графитен прът към проводника, можете да използвате подръчните инструменти като лента или тиксо. Ако не се получи да увиете върха на графита със самия проводник и лентата или изолационната лента не осигуриха плътен контакт, опитайте да залепите оловото с проводящо лепило. Ако нямате това, тогава поне завържете проводника към жицата с конец. Няма нужда да се страхувате, нишката няма да изгори от такова напрежение ??
За тези, които не знаят нищо за батериите и простите правила за свързването им, ще обясня малко. Батерията тип пръст издава напрежение 1,5 V. На снимката имам две подобни батерии. Освен това те са свързани постепенно - един след друг, а не паралелно. При подобна (серийна) връзка крайното напрежение ще се сумира от напрежението на всяка батерия, тоест за мен то е 1,5 + 1,5 = 3,0 V. Това е по-малко от посочените по-рано 6 волта. Но бях мързелив да отида да си купя още няколко батерии. Принцип ти и така трябва да е ясно ??
Нека започнем експеримента. Например ще се ограничим до електролизата на водата.Първо, той е много достъпен (надявам се, че читателят на тази статия не живее в Сахара), и второ, той е безвреден. Освен това ще покажа как с едно и също устройство (електролизатор) със същото вещество (вода) да се изпълнят две различни опит. Мисля, че имате достатъчно въображение, за да измислите куп подобни експерименти с други вещества ?? Като цяло водата от чешмата е подходяща за нас. Но препоръчвам да добавите още малко от него и да го осолите. Малко - това означава малка щипка, а не цяла десертна лъжица. Това е важно! Разбъркайте солта добре, за да се разтвори. Така че водата, като диелектрик в чисто състояние, перфектно ще провежда електричество. в началото на експеримента избършете масата от потенциална влага и след това поставете източника на енергия и чаша вода върху нея.
Спускаме двата електрода, които се намират под напрежение, във водата. В същото време се уверете, че само графитът е потопен във водата и самата жица не трябва да докосва водата. Началото на експеримента може да се забави. Времето зависи от много показатели: от състава на водата, качеството на проводниците, качеството на графита и, разбира се, напрежението на източника на енергия. Началото на реакцията ми се забави за няколко секунди. Кислородът започва да се развива върху електрода, който е бил свързан с плюса на батериите. Водородът ще се отделя върху електрода, свързан към минуса. Трябва да се отбележи, че има повече водородни мехурчета. Много малки мехурчета се залепват около частта от графита, която е потопена във водата. Тогава някои от мехурчетата започват да се носят.
Електрод в началото на експеримента. Все още няма газови мехурчета. Водородните мехурчета се образуват върху електрода, свързан с отрицателния полюс на батериите
Какви други експерименти може да има? Ако вече сте играли достатъчно с водород и кислород, ние пристъпваме към друг експеримент. По-интересно е, особено за домашните изследователи. Интересно е с това, че е възможно не само да го видите, но и да го помиришете. В миналия опит получихме кислород и водород, които според мен не са особено зрелищни. И в друг експеримент получаваме две вещества (между другото полезни в ежедневието). в началото на експеримента спрете предишния експеримент и изсушете електродите. Сега вземете трапезна сол (която използвате в повечето случаи в кухненската стая) и я разтворете във водната маса. В този случай не малка сума. Всъщност приличното количество сол е единственото нещо, което прави второто преживяване различно от първото. След разтваряне на солта можете веднага да повторите експеримента. Сега протича различна реакция. При добър електрод сега се отделя не кислород, а хлор. И в отрицателен случай се освобождава и водород. Що се отнася до стъклото, в което се намира солевият разтвор, натриевият хидроксид остава в него след продължителна електролиза. Това е познатата сода каустик, алкали.
Хлор, ще можете да го помиришете. Но за най-добър ефект препоръчвам да вземете напрежение от поне 12 V. В противен случай може да не усетите аромата. Наличието на алкал (след много дълга електролиза) в стъклото може да се провери по няколко начина. Най-простото и насилствено е да пъхнете ръка в чашата. Етническа поличба казва, че ако започне усещане за парене, в чашата има алкали. По-интелигентен и по-отчетлив начин е лакмусовият тест. Ако вашето училище е толкова бедно, че дори не е в състояние да придобие лакмус, наличните показатели ще ви помогнат. Един от тях, както се казва, може да служи като капка сок от цвекло ?? Но е напълно възможно просто да капнете малко мазнина в разтвора. Доколкото знам, осапуняването трябва да се осъществи.
За много любопитните ще опиша какво всъщност се е случило по време на експериментите. В първия експеримент, под въздействието на електрически ток, се получи подобна реакция: 2 H2O >>> 2 H2 + O2 И двата газа естествено изплуват от водата към повърхността. Между другото, плаващи газове могат да бъдат уловени. Ще можете ли да го направите сами?
В друг експеримент реакцията беше съвсем различна.Той също е иницииран от електрически ток, но сега не само водата, но и солта действа като реагенти: 4H2O + 4NaCl >>> 4NaOH + 2H2 + 2Cl2 Имайте предвид, че реакцията трябва да протече при излишък на вода. За да разберете кое количество сол се счита за най-голямо, можете да го преброите от горната реакция. Можете също така да помислите как да подобрите устройството или какви други експерименти могат да бъдат направени. Всъщност е възможно натриевият хипохлорит да бъде получен чрез електролиза. В лабораторни условия в повечето случаи се получава чрез преминаване на газообразен хлор през разтвор на натриев хидроксид.