Vandenilio gamybos būdai pramonės sąlygomis
Ekstrahavimas konvertuojant metaną
... Garų būsenos vanduo, pašildytas iki 1000 laipsnių Celsijaus, slėgio metu ir esant katalizatoriui sumaišomas su metanu. Šis metodas yra įdomus ir patikrintas, taip pat reikėtų pažymėti, kad jis nuolat tobulinamas: ieškoma naujų, pigesnių ir efektyvesnių katalizatorių.
Apsvarstykite seniausią vandenilio gamybos metodą - anglies dujinimas
... Jei nėra oro patekimo ir 1300 laipsnių Celsijaus temperatūra, kaitinamos anglys ir vandens garai. Taigi vandenilis išstumiamas iš vandens ir gaunamas anglies dioksidas (vandenilis bus viršuje, anglies dioksidas, taip pat gautas dėl reakcijos, yra apačioje). Tai bus dujų mišinio atskyrimas, viskas yra labai paprasta.
Gaunant vandenilį vandens elektrolizė
yra laikomas paprasčiausiu variantu. Jo įgyvendinimui būtina į indą supilti sodos tirpalą, taip pat ten įdėti du elektrinius elementus. Vienas bus įkrautas teigiamai (anodas), kitas - neigiamai (katodas). Įjungus srovę, vandenilis pateks į katodą, o deguonis - į anodą.
Vandenilio gavimas metodu dalinė oksidacija
... Tam naudojamas aliuminio ir galio lydinys. Jis dedamas į vandenį, dėl kurio reakcijos metu susidaro vandenilis ir aliuminio oksidas. Galis yra būtinas tam, kad reakcija vyktų visiškai (šis elementas neleis aliuminiui anksčiau oksiduotis).
Neseniai įgytas aktualumas biotechnologijos naudojimo metodas
: esant deguonies ir sieros trūkumui, chlamidomos pradeda intensyviai išskirti vandenilį. Labai įdomus efektas, kuris dabar yra aktyviai tiriamas.

Nepamirškite dar vieno seno, patikrinto vandenilio gamybos metodo, kuris apima kitokių šarminiai elementai
ir vandens. Iš esmės ši technika yra įmanoma laboratorijoje, kur taikomos būtinos saugos priemonės. Taigi, vykstant reakcijai (ji vyksta kaitinant ir katalizatoriais), susidaro metalo oksidas ir vandenilis. Belieka tik jį surinkti.
Gaukite vandenilį vandens ir anglies monoksido sąveika
įmanoma tik pramoninėje aplinkoje. Susidaro anglies dioksidas ir vandenilis, jų atskyrimo principas aprašytas aukščiau.

Vandenilio generatoriaus taikymo sritis
H2 yra modernus energijos nešėjas, aktyviai naudojamas daugelyje pramonės sričių. Čia yra tik keletas:
- vandenilio chlorido (HC) l gamyba;
- raketų paleidimo įrenginių kuro gamyba;
- amoniako gamyba;
- metalo apdirbimas ir pjovimas ant jo;
- vasarnamių trąšų kūrimas;
- azoto rūgšties sintezė;
- metilo alkoholio sukūrimas;
- maisto pramone;
- druskos rūgšties gamyba;
- šiltų grindų sistemų kūrimas.
Be to, HHO tapo labai naudingas kasdieniame gyvenime, nors ir su išlygomis. Visų pirma, jis naudojamas autonominėms šildymo sistemoms. Be to, Browno dujos dedamos į benziną bandant apgauti variklį ir sutaupyti degalų.
Abu atvejai turi savo ypatumus. Taigi, organizuodami namų šildymą, turite atsižvelgti į tai, kad HHO degimo temperatūra yra didesne tvarka didesnė nei metano. Šiuo atžvilgiu būtina įsigyti specialų, brangų katilą su karščiui atspariu antgaliu. Priešingu atveju savininkui ir jo namams kils didelis pavojus.
IŠRADIMAS TURI ŠIUS PRIVALUMUS
Šiluma, gaunama oksiduojant dujas, gali būti naudojama tiesiogiai vietoje, o vandenilis ir deguonis gaunami šalinant garų atliekas ir technologinį vandenį.
Mažas vandens suvartojimas gaminant elektrą ir šilumą.
Būdo paprastumas.
Gerai sutaupyta energijos jis išleidžiamas tik starteriui pašildyti iki nustatyto terminio režimo.
Didelis proceso našumas, nes vandens molekulių disociacija trunka dešimtąsias sekundės dalis.
Metodo sprogimas ir priešgaisrinė sauga, nes jį įgyvendinant nereikia talpyklų vandeniliui ir deguoniui rinkti.
Veikiant įrenginiui, vanduo daug kartų valomas, paverčiant distiliuotu. Tai pašalina nuosėdas ir kalkes, todėl pailgėja įrenginio tarnavimo laikas.
Montavimas pagamintas iš įprasto plieno; išskyrus katilus iš karščiui atsparių plienų su sienų pamušalu ir ekranavimu. Tai yra, nereikia jokių specialių brangių medžiagų.
Išradimas gali būti pritaikytas
pramonę pakeisdami angliavandenilius ir branduolinį kurą elektrinėse pigiu, plačiai paplitusiu ir aplinkai nekenksmingu vandeniu, išlaikydami šių jėgainių galią.
Vandenilis namuose: ar yra nauda
Mes iškart pastebime: nenaudinga vandenilio generatorių naudoti namui šildyti. Gryno H2 gamybai išleisite daugiau elektros energijos, nei gausite ją sudeginę. Taigi, už 1 kW šilumos išleidžiama 2 kW elektros energijos, tai yra, nėra jokios naudos. Bet kurį iš elektrinių katilų lengviau įsirengti namuose.
Norėdami pakeisti 1 l benziną automobiliui, jums reikės 4766 litrų gryno vandenilio arba 7150 litrų oksihidrogeninių dujų, kurių 1/3 yra deguonis. Iki šiol net geriausi pasaulio protai nėra sukūrę vieneto, galinčio pasiekti tokį pasirodymą.


PASIŪLYMAS
Vandenilio ir deguonies iš vandens garų gamybos metodas
, įskaitant šio garo praleidimą per elektrinį lauką, b e s i s k i r i a n t i tuo, kad jie naudoja perkaitinto vandens garą su temperatūra
500 - 550 o C
, praeina per aukštos įtampos nuolatinės srovės elektrinį lauką, kad atsiribotų garai ir atskirtų juos į vandenilio ir deguonies atomus.
Seniai norėjau padaryti panašų dalyką. Bet tolesni eksperimentai su baterija ir elektrodų pora nepasiekė. Norėjau pagaminti pilnavertį aparatą vandeniliui gaminti, kad būtų galima išpūsti balioną. Prieš gamindamas pilnavertį vandens elektrolizės aparatą namuose, nusprendžiau viską patikrinti pagal modelį.
Bendroji elektrolizatoriaus schema atrodo taip.
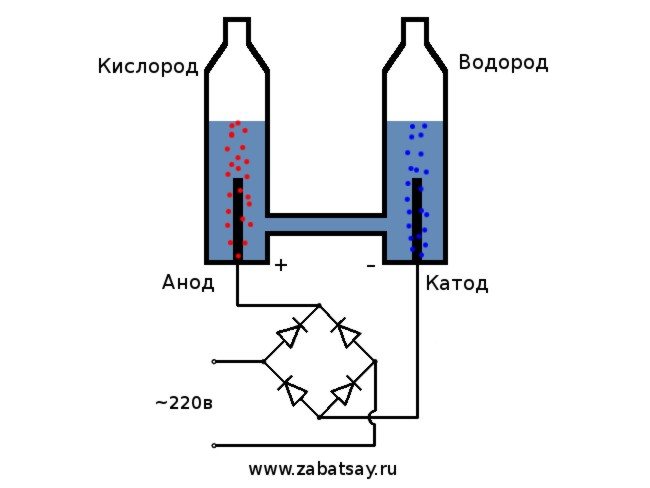

Šis modelis nėra tinkamas naudoti visą dieną. Bet mums pavyko išbandyti idėją.
Taigi nusprendžiau elektrodams naudoti grafitą. Puikus elektrodų grafito šaltinis yra troleibusų kolektorius. Galinėse stotelėse jų yra daugybė. Reikia atsiminti, kad vienas iš elektrodų sugrius.


Mes pamatėme ir baigėme su byla. Elektrolizės intensyvumas priklauso nuo srovės stiprumo ir elektrodų ploto.


Laidai tvirtinami prie elektrodų. Laidai turi būti kruopščiai izoliuoti.


Elektrolizatoriaus modelio atveju plastikiniai buteliai yra gana tinkami. Vamzdžių ir laidų dangtyje yra padarytos skylės.


Viskas kruopščiai padengta sandarikliu.


Nupjautos butelio kakleliai tinka sujungti du indus.


Juos reikia sujungti ir siūlę ištirpdyti.


Riešutai gaminami iš butelių dangtelių.


Skylės yra pagamintos iš dviejų butelių apačioje. Viskas sujungta ir kruopščiai užpildyta sandarikliu.


Kaip įtampos šaltinį naudosime 220 V buitinį tinklą. Noriu jus perspėti, kad tai gana pavojingas žaislas. Taigi, jei neturite pakankamai įgūdžių arba kyla abejonių, tuomet geriau nekartoti.Buitiniame tinkle mes turime kintamą srovę, elektrolizei ji turi būti ištiesinta. Tam puikiai tinka diodinis tiltas. Nuotraukoje esantis nebuvo pakankamai galingas ir greitai perdegė. Geriausias variantas buvo kiniškas MB156 diodinis tiltas aliuminio korpuse.


Diodų tiltas labai įkaista. Reikės aktyvaus aušinimo. Puikiai tinka aušintuvas kompiuterio procesoriui. Korpusui galima naudoti tinkamo dydžio jungiamąją dėžę. Parduodamas elektros prekėse.


Po diodiniu tiltu turi būti dedami keli kartono sluoksniai.


Jungiamosios dėžutės dangtyje padaromos būtinos skylės.


Taip atrodo surinktas agregatas. Elektrolizeris maitinamas iš tinklo, ventiliatorius maitinamas universaliu maitinimo šaltiniu. Kepamosios sodos tirpalas naudojamas kaip elektrolitas. Čia reikia atsiminti, kad kuo didesnė tirpalo koncentracija, tuo didesnis reakcijos greitis. Bet tuo pačiu metu šildymas taip pat yra didesnis. Be to, natrio skilimo reakcija katode prisidės prie kaitinimo. Ši reakcija yra egzoterminė. Dėl to susidarys vandenilio ir natrio hidroksidas.


Aukščiau esančioje nuotraukoje esantis prietaisas buvo labai karštas. Jį reikėjo periodiškai išjungti ir palaukti, kol atvės. Šildymo problema buvo iš dalies išspręsta aušinant elektrolitą. Tam panaudojau fontano siurblį ant stalo. Ilgas vamzdelis eina iš vieno butelio į kitą per siurblį ir kibirą šalto vandens.


Šio klausimo aktualumas šiandien yra gana didelis dėl to, kad vandenilio naudojimo sritis yra labai plati, o gryna forma praktiškai nėra niekur gamtoje. Štai kodėl buvo sukurta keletas metodų, leidžiančių išgauti šias dujas iš kitų junginių cheminėmis ir fizinėmis reakcijomis. Tai aptariama aukščiau esančiame straipsnyje.
Vandenilio gavimas ir grynumo tikrinimas
Vandenilį galima gauti reaguojant cinkui ir druskos rūgščiai.
Zn + 2HCl = ZnCl2 + H2
Cinkas išstumia vandenilį iš rūgščių, kaip ir visi metalai, stovintys įtampų serijoje kairėje nuo vandenilio.
Norėdami surinkti vandenilį į mėgintuvėlį, turite jį apversti aukštyn kojomis, nes vandenilis yra lengvesnis už orą ir linkęs į viršų. Šis vandenilio surinkimo būdas vadinamas „oro išstūmimo metodu“.
Pav. 1. Vandenilio gavimas ir surinkimas išstumiant orą
Mėgintuvėlis kaupia vandenilį, tačiau jame taip pat yra oro, taigi ir deguonies. Vandenilis ir deguonis yra sprogūs mišiniai. Surinktą vandenilį uždegame atplaiša. Mėgintuvėlis yra mažas, o vandenilio ir deguonies sprogimas yra tik aštrus sprogimas. Kuo mažiau deguonies mišinyje, tuo tylesnė medvilnė.
Jei mėgintuvėlyje surinktas vandenilis yra grynas, tada išgirsime nuobodų sprogimą. Toks vandenilis gali užsidegti.
Buitinis vandenilio gamyba
Elektrolizatoriaus pasirinkimas
Norėdami gauti namo elementą, jums reikia specialaus aparato - elektrolizerio. Rinkoje yra daugybė tokios įrangos variantų, prietaisus siūlo tiek žinomos technologijų korporacijos, tiek smulkieji gamintojai. Firminiai vienetai yra brangesni, tačiau konstrukcijos kokybė yra aukštesnė.
Buitinė technika yra maža ir ja lengva naudotis. Pagrindinės jo detalės:
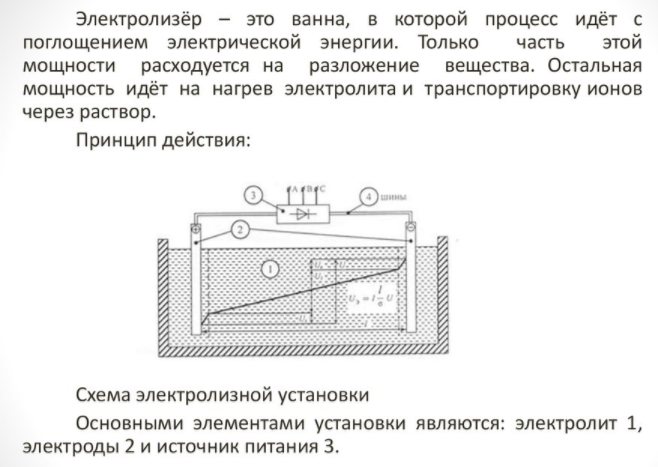

Elektrolizeris - kas tai
- reformatorius;
- valymo sistema;
- kuro elementai;
- kompresorių įranga;
- indas vandeniliui laikyti.
Paprastas vandentiekio vanduo imamas kaip žaliava, o elektra gaunama iš įprasto lizdo. Saulės energija varomi įrenginiai taupo elektros energiją.
Namų vandenilis naudojamas šildymo ar maisto ruošimo sistemose. Jie taip pat praturtina degalų ir oro mišinį, kad padidintų automobilio variklių galią.
Aparato gaminimas savo rankomis
Dar pigiau prietaisą pasigaminti namuose.Sausas elementas atrodo kaip uždaras indas, kurį sudaro dvi elektrodo plokštelės, esančios talpykloje su elektrolitiniu tirpalu. Visuotinis internetas siūlo įvairias skirtingų modelių įrenginių surinkimo schemas:
- su dviem filtrais;
- su viršutiniu arba apatiniu konteinerio išdėstymu;
- su dviem ar trimis vožtuvais;
- su cinkuota lenta;
- ant elektrodų.
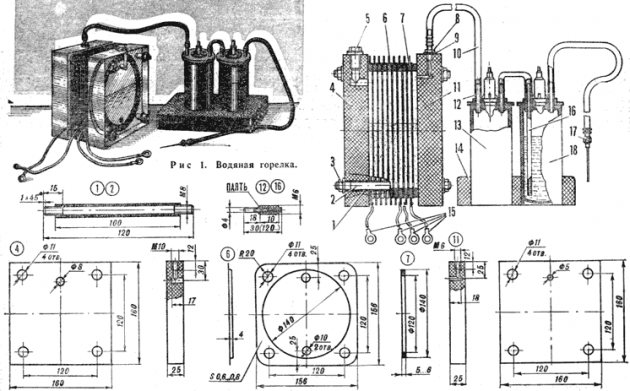

Elektrolizės įtaiso schema
Nesunku sukurti paprastą vandenilio gamybos įrenginį. Tam reikės:
- nerūdijančio plieno lakštai;
- skaidrus vamzdelis;
- jungiamosios detalės;
- plastikinė talpa (1,5 l);
- vandens filtras ir atbulinis vožtuvas.
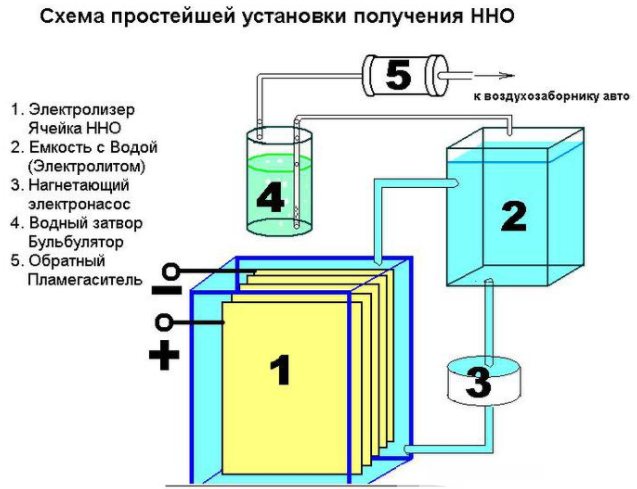

Paprasto prietaiso, skirto vandeniliui gaminti, įtaisas
Be to, reikės įvairios aparatūros: veržlės, poveržlės, varžtai. Pirmasis žingsnis yra supjaustyti lapą į 16 kvadratinių skyrių, iškirpti kampą iš kiekvieno iš jų. Priešingame kampe nuo jo reikia išgręžti skylę plokščių varžtams tvirtinti. Norint užtikrinti pastovią srovę, plokštės turi būti sujungtos pagal pliuso - minuso - pliuso - minuso schemą. Šios dalys yra izoliuotos viena nuo kitos vamzdžiu, o sujungiant varžtu ir poveržlėmis (trys dalys tarp plokščių). 8 plokštelės dedamos ant pliuso ir minuso.
Tinkamai surinkus plokštelių šonkaulius nelies elektrodai. Surinktos dalys nuleidžiamos į plastikinį indą. Toje vietoje, kur sienos liečia varžtus, padaromos dvi tvirtinimo angos. Norėdami pašalinti dujų perteklių, įdiekite apsauginį vožtuvą. Jungiamosios detalės montuojamos konteinerio dangtyje, o siūlės sandarinamos silikonu.
Aparato bandymas
Norėdami išbandyti įrenginį, atlikite kelis veiksmus:
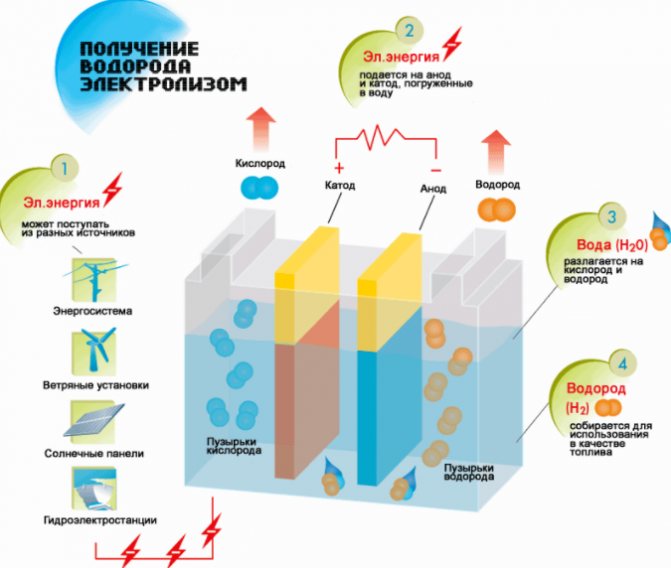

Vandenilio gamybos schema
- Užpildykite skysčiu.
- Uždengdami dangčiu, prijunkite vieną vamzdžio galą prie jungiamosios detalės.
- Antrasis panardinamas į vandenį.
- Prijunkite prie maitinimo šaltinio.
Prijungus prietaisą prie lizdo, po kelių sekundžių bus pastebimas elektrolizės procesas ir krituliai.
Grynas vanduo neturi gero laidumo elektrai. Norėdami pagerinti šį rodiklį, turite sukurti elektrolitinį tirpalą, pridedant šarmo - natrio hidroksido. Jo yra vamzdžių valymo junginiuose, pavyzdžiui, „Mole“.
Vandenilio gamybos metodai
Vandenilis yra bespalvis ir bekvapis dujinis elementas, kurio tankis oro atžvilgiu yra 1/14. Laisvoje valstybėje tai reta. Paprastai vandenilis derinamas su kitais cheminiais elementais: deguonimi, anglimi.
Vandenilio gamyba pramonės ir energetikos reikmėms vykdoma keliais būdais. Populiariausi yra:
- vandens elektrolizė;
- koncentracijos metodas;
- žemos temperatūros kondensatas;
- adsorbcija.
Vandenilį galima išskirti ne tik iš dujinių ar vandens junginių. Vandenilis gaminamas veikiant medieną ir anglį aukštai temperatūrai, taip pat apdorojant biologines atliekas.
Atominis vandenilis energetikos inžinerijai gaunamas naudojant molekulinės medžiagos terminio disociacijos metodą ant vielos, pagamintos iš platinos, volframo ar paladžio. Jis kaitinamas vandenilio atmosferoje, esant mažesniam nei 1,33 Pa slėgiui. Taip pat vandeniliui gaminti naudojami radioaktyvūs elementai.

Terminis atsiribojimas
Elektrolizės metodas
Paprasčiausias ir populiariausias vandenilio evoliucijos metodas yra vandens elektrolizė. Tai leidžia gaminti praktiškai gryną vandenilį. Apsvarstyti kiti šio metodo pranašumai:
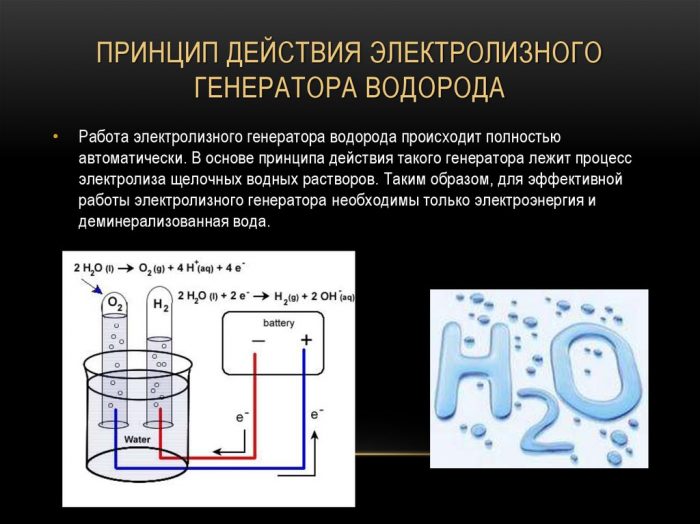

Elektrolizės vandenilio generatoriaus veikimo principas
- žaliavų prieinamumas;
- priimant slėgio elementą;
- galimybė automatizuoti procesą dėl judančių dalių trūkumo.
Skysčio padalijimo elektrolizės būdu procedūra yra atvirkštinė vandenilio degimui. Jo esmė ta, kad veikiant tiesioginei srovei, deguonis ir vandenilis išsiskiria ant elektrodų, panardintų į vandeninį elektrolito tirpalą.
Papildomu pranašumu laikoma pramoninės vertės šalutinių produktų gamyba.Taigi, norint paskatinti energetikos sektoriaus technologinius procesus, išvalyti dirvožemį ir vandens telkinius bei išmesti buitines atliekas, reikia didelio deguonies kiekio. Elektrolizės metu gautas sunkusis vanduo naudojamas branduolinių reaktorių energetikoje.
Vandenilio gamyba koncentruojant
Šis metodas pagrįstas elemento atskyrimu nuo dujų mišinių, kuriuose yra jo. Taigi, didžiausia pramonės produkcijos dalis yra gaunama metano riformingo būdu. Šiame procese išgautas vandenilis naudojamas energetikos, naftos perdirbimo, raketų statybos pramonėje, taip pat azoto trąšų gamybai. H2 gavimo procesas atliekamas įvairiais būdais:
- trumpas ciklas;
- kriogeninis;
- membrana.
Pastarasis metodas laikomas efektyviausiu ir pigesniu.

Žemos temperatūros kondensatas
Šis H2 gavimo būdas yra stiprus dujinių junginių aušinimas esant slėgiui. Dėl to jie transformuojami į dviejų fazių sistemą, kuri vėliau separatoriumi atskiriama į skystą komponentą ir dujas. Skystos terpės naudojamos aušinimui:
- vanduo;
- suskystintas etanas arba propanas;
- skystas amoniakas.


Ši procedūra nėra tokia lengva, kaip atrodo. Švariai atskirti angliavandenilių dujų vienu metu nebus įmanoma. Kai kurie komponentai išeis iš dujų, paimtų iš atskyrimo skyriaus, o tai nėra ekonomiška. Problemą galima išspręsti giliai atvėsinant žaliavą prieš atskiriant. Tačiau tam reikia daug energijos.
Šiuolaikinėse žemos temperatūros kondensatorių sistemose papildomai pateikiamos demetanizavimo arba deetanizavimo kolonos. Dujų fazė pašalinama iš paskutinio atskyrimo etapo, o po šilumos mainų skystis su neapdorotų dujų srove siunčiamas į distiliavimo kolonėlę.
Adsorbcijos metodas
Adsorbcijos metu vandeniliui išskirti naudojami adsorbentai - kietosios medžiagos, sugeriančios būtinus dujų mišinio komponentus. Kaip adsorbentai naudojama aktyvuota anglis, silikatinis gelis, ceolitai. Šiam procesui atlikti naudojami specialūs įtaisai - cikliniai adsorbentai arba molekuliniai sietai. Įgyvendinus slėgį, šis metodas gali atgauti 85% vandenilio.
Jei palyginsime adsorbciją su žemos temperatūros kondensacija, galime pastebėti mažesnes proceso medžiagos ir eksploatacijos išlaidas - vidutiniškai 30 proc. Vandenilis gaminamas adsorbuojant energetikai ir naudojant tirpiklius. Šis metodas leidžia iš dujų mišinio ekstrahuoti 90 procentų H2 ir gauti galutinį produktą, kurio vandenilio koncentracija yra iki 99,9%.