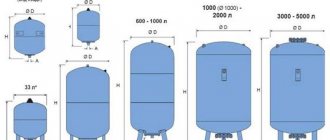
Један од многих физичко-хемијских процеса који су нашли широку примену, како у индустрији, тако и у свакодневном животу, је електролиза - избор на површинама електрода повезаних са извором струје смештеним у раствор или растоп, њихове компоненте (чисти метал - алуминијум, бакар, гас итд.). Главна инсталација унутар које се одвија овај процес је електролизатор.

Електролизатор
Шта је електролизатор
Електролизатор је посебна инсталација која се користи за одвајање његових састојака од раствора или топљења.
Главне карактеристике електролизера су:
- Радни напон једне електроде креће се од 1,8 до 2,0 В;
- Снага струје - за нормалан ток процеса електролизе, на електроде се доводи струја са вредношћу ове карактеристике од 5 до 10 А;
- Број електрода - минимални број електрода је 2, максимум је ограничен величином саме инсталације и њеном наменом;
- Димензије електрода - као електроде се не користе карбонске шипке, већ металне плоче, чија величина је одређена сврхом инсталације, струјно-напонска карактеристика струје која се доводи на плоче;
- Растојање између површина супротно наелектрисаних електрода - минимално растојање између плоча електроде мора бити најмање 1,5 мм;
- Материјал електроде - у савременим електролизаторима, нерђајући челични лим са никлом користи се као материјал за аноду и катоду.
Такође друга важна карактеристика постројења за електролизу је употреба катализатора.
Такве инсталације се користе у следеће сврхе:
- Добијање гаса оксихидрогена, који се састоји од мешавине водоника и кисеоника (Браунов гас);
- Изолација чистог алуминијума, магнезијума, цинка из њихових растопљених соли;
- Пречишћавање воде од соли и нечистоћа растворених у њој;
- Наношење танког слоја никла, цинка који спречава корозију на површини металних делова;
- Дезинфекција прехрамбених производа;
- Пречишћавање отпадних вода од растворених соли тешких метала и других штетних материја.
Важно! Платина-електрода од обичног гвожђа користи се ређе у постројењима за електролизу него од нерђајућег челика, јер брже оксидира и постаје неупотребљива.
Самостални електролизатор
Свако може направити електролизатор сопственим рукама. За поступак монтаже најчешћег дизајна биће потребни следећи материјали:
- лим од нерђајућег челика (најбоље опције су страни АИСИ 316Л или наш 03Кс16Х15М3);
- вијци М6х150;
- подлошке и матице;
- провидна цев - можете користити либелу, која се користи у грађевинске сврхе;
- неколико фитинга са рибља кост спољног пречника 8 мм;
- пластична посуда запремине 1,5 литара;
- мали филтер који филтрира воду из славине, на пример, филтер за машине за прање веша;
- неповратни вентил за воду.
Процес монтаже
Прикупите електролизатор сопственим рукама према следећим упутствима:
- Пре свега, морате означити и накнадно пиљење лима од нерђајућег челика на идентичне квадрате. Тестерисање се може изводити помоћу угаоне брусилице (угаоне брусилице). Један од углова на таквим квадратима мора бити исечен под углом да би се плоче правилно учврстиле;
- Даље, потребно је да направите рупу за вијак на страни плоче супротно од реза угаоне тестере;
- Повезивање плоча треба вршити заузврат: једна плоча на "+", следећа на "-" и тако даље;
- Између различито наелектрисаних плоча треба да постоји изолатор, који делује као цев од либеле.Треба га исећи на прстенове, које треба пресећи по дужини да се добију траке дебљине 1 мм. Ово растојање између плоча је довољно за добро издвајање гасова током електролизе;
- Плоче су међусобно причвршћене помоћу подложних плочица на следећи начин: подложна плочица седи на сворњаку, затим плоча, па три подлошке, након плоче итд. Плоче, повољно напуњене, постављају се у зрцалну слику негативно наелектрисаних листова. То омогућава спречавање додиривања резаних ивица са електродама;


Плоче постројења за електролизу састављене заједно
- Приликом састављања плоча, истовремено их треба изоловати и затегнути матице;
- Такође, свака плоча мора бити прстенована како би се осигурало да нема кратког споја;
- Даље, цео склоп мора бити смештен у пластичну кутију;
- После тога, вреди истакнути места на којима вијци додирују зидове контејнера, где бушите две рупе. Ако се вијци не уклапају у контејнер, онда их треба резати тестером;
- Затим су вијци затегнути наврткама и подлошкама за непропусност конструкције;


Плоче смештене у пластичну посуду
- Након предузетих корака, мораћете да направите рупе на поклопцу контејнера и убаците фитинге у њих. Непропусност у овом случају може се осигурати заптивањем спојева заптивачима на бази силикона;
- Сигурносни вентил и филтер у структури налазе се на излазу из гаса и служе као средство за контролу прекомерне акумулације гаса, што може довести до лоших резултата;
- Јединица за електролизу је састављена.
Последња фаза је тест који се изводи на сличан начин:
- пуњење посуде водом до ознаке вијака за причвршћиваче;
- повезивање напајања на уређај;
- прикључак на фитинг цеви, чији се супротни крај спушта у воду.
Ако се у инсталацију доведе слаба струја, тада ће испуштање гаса кроз цев бити готово неприметно, али биће могуће гледати је из унутрашњости електролизера. Повећавањем наизменичне струје, додавањем алкалног катализатора у воду, принос гасовите супстанце може се знатно повећати.
Израђени електролизатор је, по правилу, важан део многих уређаја, на пример, водоник горионика.


изглед водоничног горионика, чија се основа сматра сопственим електролизатором
Познавајући врсте, кључне карактеристике, уређај и принцип рада јонских инсталација, можете извршити правилан склоп самоизрађене конструкције, која је одличан асистент у различитим свакодневним ситуацијама: од заваривања и штедње потрошње горива моторних возила до функционисање система грејања.
Уређај и принцип рада
Катода и анода
Најједноставнија биљка за електролизу састоји се од неколико „ћелија“, од којих свака укључује:
- 2 електроде са плочама - катода (негативна) и анода (позитивна);
- Гумена заптивка око периметра две суседне различите електроде.
Спољне ћелије су опремљене посебним цевима кроз које се испуштени гасови испуштају.
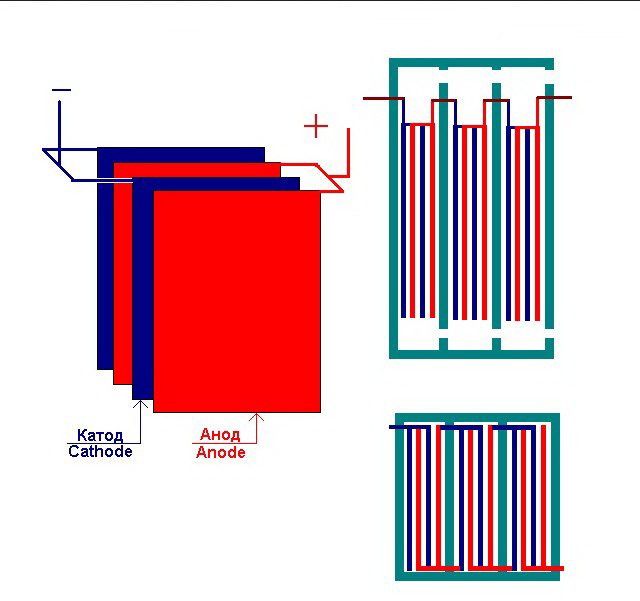

Неколико међусобно повезаних „ћелија“ постројења за електролизу
Електролизатор може садржати од 1 до 30-40 или више таквих „ћелија“, истоимене плоче су повезане у серију.
Важно! Када се користе напајања наизменичном струјом, додатно се користе исправљачи, од којих је најједноставнији диодни мост.
Таква инсталација ради на следећи начин:
- Дестилована вода у којој су растворене алкалије или обична сода бикарбона сипају се у простор између електрода;
- Напон од 1,8-2,0 В се напаја из напајања на електроде свих ћелија инсталације;
- Као резултат процеса електролизе, аниони (позитивно наелектрисани јони) супстанце растворене у води привлаче се на негативно наелектрисану катоду, услед чега се на њој формира танак натријум филм;
- На позитивно наелектрисаној аноди долази до уништавања молекула воде, са сваким формираним по 2 атома водоника и 1 атомом кисеоника;
- Ослобођени детонирајући гас кроз одвојне цеви улази у контејнер намењен њему.
Интензитет процеса електролизе зависи од напона и јачине струје - при малим вредностима ових карактеристика процес се неће одвијати. Ако извор напајања напаја струју са превисоким вредностима струјно-напонске карактеристике, раствор уливен у електролизатор биће веома врућ и кључаће.
Отклањање грешака и тестирање уређаја
Затим је неопходно утврдити где вијци додирују зидове кутије и на тим местима избушите две рупе. Ако се без очигледног разлога испостави да се вијци не уклапају у контејнер, онда би требали исеците и затегните за непропусност наврткама... Сада морате избушити поклопац и уметнути навојне конекторе тамо са обе стране. Да би се осигурала непропусност, спој треба заптивати заптивачем на бази силикона.
Након састављања сопственог електролизера сопственим рукама, требало би да га тестирате. Да бисте то урадили, повежите уређај са извором напајања, напуните га водом до вијака, ставите на поклопац повезивањем цеви на фитинг и спуштањем супротног краја цеви у воду. Ако је струја слаба, тада ће струја бити видљива изнутра у електролизатору.
Постепено повећавајте струју у вашем домаћем уређају. Дестилирана вода не води добро електричну енергију јер не садржи соли или нечистоће. Да бисте припремили електролит, потребно је додати алкалију у воду. Да бисте то урадили, потребно је да узмете натријум хидроксид (садржан у средствима за чишћење цеви типа "Моле"). За спречавање накупљања пристојне количине гаса потребан је сигурносни вентил.
- Боље је користити дестиловану воду и сода као катализатор.
- Требало би помешати мало соде бикарбоне са четрдесет делова воде. Зидови на боковима најбоље су израђени од акрилног стакла.
- Електроде су најбоље израђене од нерђајућег челика. Има смисла користити злато за плоче.
- За подлогу користите провидни ПВЦ. Они могу бити величине 200 са 160 милиметара.
- Можете користити сопствени електролизатор који сте сами направили за кување хране за потпуно сагоревање бензина у аутомобилима и у већини случајева.
Суви електролизатори се углавном користе за машине. Генератор повећава снагу мотора са унутрашњим сагоревањем. Водоник се запали много брже од течног горива, повећавајући силу клипа. Поред Моле, можете узети Мистер Мусцле, каустичну сода, соду бикарбону.
Генератор не ради на води за пиће. Боље је електричну енергију повезати овако: прва и последња плоча - минус, а на плочи у средини - плус. Што је већа површина плоча и што је јача струја, више гаса се ослобађа.
Врсте електролизатора
Направи сам кућно заваривање за батерије
У зависности од дизајна и принципа рада, постоји 5 врста постројења за електролизу.
СУВ
Ови електролизатори се састоје од плочастих електрода одвојених заптивеним гуменим заптивкама. Често су "ћелије" инсталације додатно смештене у затворено кућиште.
Водоник и кисеоник који настају као резултат електролизе уклањају се кроз посебне одвојне цеви смештене на крају тела или крајњим плочама инсталације.
Тече
Постројења за електролизу овог типа имају следећи уређај:
- Купка за електролизу (тело) са две млазнице, кроз коју се у њу доводи електролит, кроз другу се испушта детонирајући гас настао као резултат електролизе;
- Плочасте електроде одвојене одстојницима;
- Резервоар са електролитом смештен изнад кућишта са електродама и повезан цревима са одвојним цевима електролизног купатила постројења и који у горњем делу има одвојну цев са гасним вентилом.
Током рада таквог уређаја, развијени гас кроз одвојну цев и црево улази у резервоар са електролитом и, стварајући у њему одређени притисак, напушта инсталацију кроз вентил на одвојној цеви.
Мембрана
Ћелије за електролизу таквих инсталација састоје се од две електроде одвојене танком мембраном која омогућава пролазак производа електролизе и одваја електроде једна од друге.
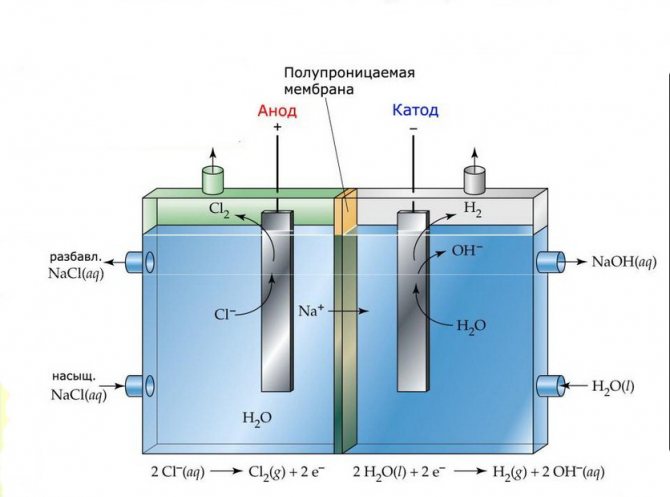

Постројење мембранске електролизе
Дијафрагма
Инсталације за електролизу овог типа састоје се од тиквице у облику слова „У“ са две електроде уметнуте у њу и 2-3 непропусне дијафрагме. Слични електролизатори се користе за одвојену производњу чистог водоника и кисеоника.
Алкална
За разлику од других модела електролизатора, у њима се алкални раствор користи као електролит - каустична сода (натријум хидроксид), која није само додатни извор водоника и кисеоника, већ и катализатор за електролизу.


Алкални круг електролизера
Такве инсталације, за разлику од аналога других врста, омогућавају употребу јефтинијих електрода од обичног гвожђа.
Урадите електролизатор сопственим рукама
Сигурно вам је познат процес електролизе из наставног програма основне школе. То је случај када се 2 поларне електроде ставе у воду под струјом да би се добили метали или неметали у њиховом чистом облику. Електролизатор је потребан за разградњу молекула воде на кисеоник и водоник. Електролизатор, као део научних механизама, дели молекуле на јоне.
Постоје две врсте овог уређаја:
- Суви електролизатор (ово је потпуно затворена ћелија);
- Мокри електролизатор (то су две металне плочице смештене у посуду са водом).
Овај уређај је једноставан у погледу уређаја, што га омогућава користите чак и код куће... Електролизатори деле наелектрисане набоје атома молекула у наелектрисане атоме.
У нашем случају дели воду на позитиван водоник и негативни кисеоник. За то је потребна велика количина енергије, а да би се смањила потребна енергија, користи се катализатор.
Електролизатор за производњу водоника
Прорачун уземљења
Да бисте властитим рукама саставили најједноставнији електролизатор, можете користити цртеж приказан на слици.


Цртеж најједноставнијег домаћег електролизера
Белешка! Електролизатор је прилично опасна инсталација која током рада гасовити кисеоник, акумулирајући се у великим количинама, може изазвати озбиљну експлозију. Уређај не сме бити постављен у близини извора отворене ватре, уређаја за грејање.
Уради сам електролизатор за аутомобил
Да би се побољшало сагоревање горива у мотору аутомобила, често се саставља електролизатор, који се састоји од кућишта од старе батерије са плочама од нерђајућег челика смештених унутра, две млазнице, од којих је једна повезана са резервоаром напуњеним електролитом, а друга је повезан са цревом за довод ваздуха на мотор (тачније, са валовитим од усиса за ваздух до филтера за ваздух).
Такав домаћи проточни електролизатор напаја се из акумулатора аутомобила помоћу релеја и осигурача од 10 А.
Стварамо уређај властитим рукама
Уређај за овај поступак може се извршити ручно.
За ово ће вам требати:
- Лим од нерђајућег челика;
- Вијци М6 к 150;
- Подлошке;
- Нутс;
- Прозирна цев;
- Повезивање елемената навојем на обе стране;
- Један и по литар пластичне посуде;
- Филтер за воду;
- Неповратни вентил за воду.
Одлична опција за нерђајући челик је АИСИ 316Л страног произвођача или 03Кс16Х15М3 произвођача из наше земље. Апсолутно нема потребе за куповином нерђајућег челика, можете узети стари. Довољно вам је 50 до 50 центиметара.
„Зашто узимати сам нерђајући челик?“ - питате. Пошто ће најчешћи метал нагризати. Нерђајући челик боље подноси лужине. Требало би оцртајте лист на такав начин да га поделите на 16 сличних квадрата... Можете га исећи помоћу угаоне брусилице. У сваком квадрату исеците један од углова.
На другој страни и супротном углу, из отсеченог угла, избушите рупу за вијак који ће вам помоћи да плоче држите заједно. Електролизатор не престаје да ради овако:т плоча струја тече на плочу - и вода се разлаже на кисеоник и водоник. Захваљујући томе, потребна нам је добра и негативна плоча.
Плоче морају бити повезане наизменично: плус-минус-плус-минус, сличном методом биће јака струја. За изолацију плоча једну од једне користи се цев. Прстен је одсечен од нивоа. Његовим резањем добијамо траку дебљине милиметра. Ова удаљеност је исправнија за прављење гаса.
Плоче су међусобно повезане подлошкама: на вијак смо поставили подлошку, затим плочу и три подлошке, па опет плочу итд. На плус и минус, мора се посадити осам плоча. Ако се све уради правилно, резови плоча неће додиривати електроде.
Затим морате затегнути матице и изоловати плоче. Затим ставимо структуру у пластичну посуду.
Преглед произвођача електролизера
Главни произвођачи електролизатора су оба домаћа предузећа (РУСАЛ, НПФ РутТецх, ЈСЦ Уралкхиммасх), као и њихови инострани конкуренти - Теледине Енерги Системс, Инц (САД), Хидрогеницс Цорп. (Белгија).
Дакле, електролизатор је прилично једноставна и богата карактеристикама инсталација која се користи за производњу гаса са оксиводоником, а који се у будућности планира користити као гориво за моторе са унутрашњим сагоревањем и грејне котлове.
Уради сам кућну електролизу
Кад сам био мали, увек сам желео да нешто радим сам, својим рукама. Али родитељи (и други блиски људи) у већини случајева то нису дозволили. И тада нисам видео (а ни до сада не видим) ништа лоше када мала деца желе да науче ??
Наравно, нисам написао овај чланак да бих се присетио искустава из детињства у жељи да започнем самообразовање. Случајно, док сам сурфовао Интернетом, наишао сам на питање ове врсте. Неки мали дечак бомбардер постављао је питања о томе како радити електролизу код куће. Истина, нисам му одговорио, јер је овај дечак желео да електролизује болно сумњиву смешу ?? Одлучио сам да нећу даље рећи из греха, него да и сам погледам у књиге. Али не тако давно, поново лутајући форумима, видео сам слично питање наставника у хемијској школи. Судећи по опису, његова школа је толико сиромашна да не може (не жели) да купи електролизатор за 300 рубаља. Учитељ (какав проблем!) Није могао да нађе излаз из настале ситуације. Па сам му помогао. За оне који су радознали у вези са овом врстом домаћих производа, постављам овај чланак на веб локацију.
Заправо, производни процес и употреба наше самопалете врло су примитивни. Али прво ћу вам рећи о сигурности, а о производњи - другом. Ствар је у томе што говоримо о демонстрацијском електролизатору, а не о индустријском постројењу. Захваљујући томе, из безбедносних разлога било би добро напајати га не из мреже, већ од АА батерија или од батерије. Природно, што је већи напон, то ће процес електролизе ићи брже. Међутим, за визуелно посматрање мехурића гаса је сасвим довољно 6 В., али 220 је већ прекомерно. са таквим напоном, вода ће, на пример, најбрже кључати, а ово није баш сигурно ... Па, мислим да сте схватили напетост?
Хајде сада да разговарамо о томе где и под којим условима ћемо експериментисати. Прва ствар, то би требао бити или слободан простор или добро проветрена соба. Иако сам све радио у стану са затвореним прозорима и ништа слично? Друго, експеримент је најбоље обавити на добром столу. Реч „добар“ значи да сто мора бити стабилан, а боље тежак, крут и причвршћен за подну површину. У овом случају, покривач стола мора бити отпоран на агресивне супстанце. Узгред, плочица са плочице је савршена за ово (иако не свака, нажалост). Овакав сто ће вам добро доћи не само за ово искуство. Међутим, све сам радио на обичној столици ?? Треће, током експеримента не треба да померате извор напајања (у мом случају, батерије). Због тога је, због поузданости, најбоље одмах их положити на сто и поправити тако да се не померају. Верујте ми, ово је згодније него да их редовно држите рукама. Једноставно сам своје батерије везао електричном траком за први тврди предмет који сам видео. Четврто, јела у којима ћемо експериментисати, нека буду мала. Једноставно стакло одговара чаши. Иначе, ово је најоптималнији начин употребе наочара код куће, за разлику од даљег уливања алкохола у њих ...
Па, сада пређимо конкретно на уређај. То је дато на слици, али за сада ћу укратко објаснити шта и шта.
Треба да узмемо једноставну оловку и уклонимо дрво са ње обичним ножем и из оловке извадимо читав олово. Међутим, можете да поведете са механичке оловке. Али две су потешкоће одједном. Прва је уобичајена. Олово од механичке оловке је сувише танко, за нас ово једноставно није погодно за визуелни експеримент. Друга потешкоћа је нека неразумљива композиција тренутне плоче. Осећа се као да нису направљени од графита, већ од нечег другог. Генерално, моје искуство са таквим „оловом“ уопште није било успешно, чак ни при напону од 24 В. Захваљујући томе, требало је да одаберем добру дрвенасту једноставну оловку. Добијени графитни штап ће нам служити као електрода. Као што можете да замислите, требају нам две електроде. Захваљујући томе, идемо да одаберемо другу оловку или једноставно сломимо постојећу шипку на два дела. Заправо сам ово урадио.
Било којом жицом која нам дође под руку, омотамо прву електроду са оловом (једним крајем жице) и ову жицу повезујемо са минусом извора напајања (са другим крајем). Тада преузимамо друго вођство и чинимо исто са њим. За ово, на основу овога, потребна нам је друга жица. Али у овом случају, ову жицу повезујемо са плусом напајања. Ако имате проблема са причвршћивањем крхке графитне шипке на жицу, можете да користите приручни алат као што је трака или селотејп. Ако није успело да врх графита омотате самом жицом, а трака или изолациона трака нису обезбедиле чврст контакт, онда покушајте да лепак залепите проводљивим лепком. Ако немате ово, онда бар навој привежите олово за жицу. Не треба се плашити, нит неће прегорети од такве напетости ??
За оне који не знају ништа о батеријама и једноставним правилима њиховог повезивања, објаснићу мало. Прстна батерија производи напон од 1,5 В. На слици имам две сличне батерије. Штавише, они су повезани постепено - један за другим, не паралелно. Са сличним (серијским) прикључком, коначни напон ће се сабрати из напона сваке батерије, односно за мене је 1,5 + 1,5 = 3,0 В. То је мање од претходно наведених 6 волти. Али био сам лењ да бих отишао да купим још неколико батерија. Принцип ти мора бити јасан ??
Почнимо са експериментом. На пример, ограничићемо се на електролизу воде.Прво, врло је доступан (надам се да читалац овог чланка не живи у Сахари), и друго, безопасан је. Штавише, показаћу како са истим уређајем (електролизатором) са истом супстанцом (водом) извршити два разним искуство. Мислим да имате довољно маште да смислите гомилу сличних експеримената са другим супстанцама ?? Генерално, вода из славине је погодна за нас. Али препоручујем да га додате још мало и посолите. Помало - ово значи малу прстохват, а не целу кашику за десерт. То је важно! Добро промешајте сол да се раствори. Тако ће вода, будући да је диелектрик у чистом стању, савршено водити електричну енергију. на почетку експеримента обришите сто од потенцијалне влаге, а затим на њега ставите извор напајања и чашу воде.
Спуштамо обе воде, присутне под напоном, у воду. Истовремено, уверите се да је само графит уроњен у воду, а сама жица не би требало да додирује воду. Почетак експеримента може бити одложен. Време зависи од многих показатеља: од састава воде, квалитета жица, квалитета графита и, наравно, напона извора напајања. Почетак моје реакције одложен је на неколико секунди. Кисеоник почиње да се развија на електроди која је била повезана са плусом батерија. Водоник ће се ослободити на електроди повезаној са минусом. Треба напоменути да има више мехурића водоника. Врло мали мехурићи се лепе око дела графита који је уроњен у воду. Тада неки од мехурића почињу да лебде.
Електрода на почетку експеримента. Још нема мехурића гаса. Мехурићи водоника настали су на електроди која је повезана са негативним полом батерија
Који још могу бити експерименти? Ако сте се већ довољно поиграли са водоником и кисеоником, прећи ћемо на други експеримент. Занимљивије је, посебно за домаће истраживаче. Занимљиво је по томе што је могуће не само видети, већ и осетити мирис. У прошлом искуству смо добили кисеоник и водоник, који по мом мишљењу нису баш спектакуларни. А у другом експерименту добијамо две супстанце (иначе корисне у свакодневном животу). на почетку експеримента зауставите претходни експеримент и осушите електроде. Сада узмите кухињску сол (коју обично користите у кухињској соби) и растворите је у воденој маси. У овом случају, не мали износ. Заправо, пристојна количина соли је једина ствар која друго искуство разликује од првог. Након растварања соли, можете одмах поновити експеримент. Сада се одвија другачија реакција. На доброј електроди сада се не ослобађа кисеоник, већ хлор. А негативно, водоник се такође ослобађа. Што се тиче чаше у којој се налази раствор соли, натријум хидроксид остаје у њему након продужене електролизе. Ово је позната каустична сода, алкалија.
Хлор, моћи ћете да га осетите. Али за најбољи ефекат, препоручујем узимање напона од најмање 12 В. У супротном, можда нећете осетити арому. Присуство алкалије (након веома дуге електролизе) у стаклу може се проверити на више начина. Најједноставније и најнасилније је ставити руку у чашу. Етнички предзнак каже да ако започне осећај сагоревања, у чаши су алкалије. Паметнији и јаснији начин је лакмусов тест. Ако је ваша школа толико сиромашна да није у стању ни да стекне лакмус, помоћи ће вам прикладни показатељи. Један од њих, како кажу, може послужити као кап сока репе ?? Али сасвим је могуће само укапати мало масти у раствор. Колико знам, сапонификација би требало да се догоди.
За врло радознале, описаћу шта се заправо догодило током експеримената. У првом експерименту, под утицајем електричне струје, догодила се слична реакција: 2 Х2О >>> 2 Х2 + О2 Оба гаса природно плутају из воде на површину. Иначе, плутајући гасови могу бити заробљени. Хоћете ли то моћи сами?
У другом експерименту реакција је била потпуно другачија.Покренула га је и електрична струја, али сада није реаговала само вода, већ и сол: 4Х2О + 4НаЦл >>> 4НаОХ + 2Х2 + 2Цл2 Имајте на уму да се реакција мора одвијати у вишку воде. Да бисте сазнали која се количина соли сматра највећом, можете је избројати из горње реакције. Још увек можете размишљати о томе како побољшати уређај или које друге експерименте можете обавити. Заиста, могуће је да се натријум хипохлорит може добити електролизом. У лабораторијским условима, у већини случајева се добија пропуштањем гасовитог хлора кроз раствор натријум хидроксида.