Metode dobivanja vodika u industrijskim uvjetima
Vađenje konverzijom metana
... Voda u parnom stanju, prethodno zagrijana na 1000 Celzijevih stupnjeva, miješa se s metanom pod pritiskom i u prisutnosti katalizatora. Ova je metoda zanimljiva i dokazana, treba napomenuti i da se neprestano poboljšava: u tijeku je potraga za novim katalizatorima, jeftinijim i učinkovitijim.
Razmotrimo najstariju metodu proizvodnje vodika - uplinjavanje ugljena
... Pod uvjetom da nema pristupa zraku i da se zagrijava temperatura od 1300 Celzijevih stupnjeva, ugljen i vodena para. Dakle, vodik se istiskuje iz vode i dobiva se ugljični dioksid (vodik će biti na vrhu, ugljični dioksid, također dobiven kao rezultat reakcije, na dnu). Ovo će biti odvajanje mješavine plina, sve je vrlo jednostavno.
Dobivanje vodika pomoću elektroliza vode
smatra se najjednostavnijom opcijom. Za njegovu provedbu potrebno je u posudu uliti otopinu sode, a tamo smjestiti i dva električna elementa. Jedna će biti nabijena pozitivno (anoda), a druga negativno (katoda). Kada se primijeni struja, vodik će ići na katodu, a kisik na anodu.
Dobivanje vodika metodom djelomična oksidacija
... Za to se koristi legura aluminija i galija. Stavlja se u vodu, što dovodi do stvaranja vodika i glinice tijekom reakcije. Galij je potreban da bi se reakcija odvijala u cijelosti (ovaj će element spriječiti da aluminij prerano oksidira).
Nedavno stečena relevantnost metoda korištenja biotehnologije
: pod uvjetom nedostatka kisika i sumpora, klamidomonas počinje intenzivno oslobađati vodik. Vrlo zanimljiv efekt koji se sada aktivno proučava.

Ne zaboravite još jednu staru, provjerenu metodu proizvodnje vodika, koja se sastoji u korištenju različitih alkalni elementi
i vode. U principu, ova je tehnika izvediva u laboratorijskim uvjetima s potrebnim sigurnosnim mjerama. Tako se tijekom reakcije (nastavlja se zagrijavanjem i s katalizatorima) stvaraju metalni oksid i vodik. Ostaje samo prikupiti.
Nabavite vodik interakcija vode i ugljičnog monoksida
moguće samo u industrijskom okruženju. Stvaraju se ugljični dioksid i vodik, gore je opisan princip njihovog razdvajanja.

Opseg generatora vodika
H2 je moderni nosač energije koji se aktivno koristi u mnogim industrijskim područjima. Evo samo nekoliko:
- proizvodnja klorovodika (HC) l;
- proizvodnja goriva za raketne bacače;
- proizvodnja amonijaka;
- obrada metala i rezanje na njemu;
- razvoj gnojiva za ljetne vikendice;
- sinteza dušične kiseline;
- stvaranje metilnog alkohola;
- industrija hrane;
- proizvodnja solne kiseline;
- stvaranje sustava toplih podova.
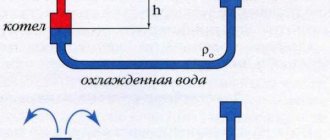
Osim toga, HHO je postao vrlo koristan u svakodnevnom životu, iako s rezervom. Prije svega, koristi se za autonomne sustave grijanja. Uz to, Brownov se plin dodaje u benzin u pokušaju da prevari motor i uštedi na gorivu.
Oba slučaja imaju svoje osobitosti. Dakle, prilikom organiziranja kućnog grijanja, morate uzeti u obzir da je temperatura izgaranja HHO-a za red veličine viša od temperature metana. S tim u vezi, potrebno je kupiti poseban, skupi kotao s mlaznicom otpornom na toplinu. U protivnom će vlasnik i njegov dom biti u znatnoj opasnosti.
IZUM IMA SLJEDEĆE PREDNOSTI
Toplina dobivena oksidacijom plinova može se koristiti izravno na gradilištu, a vodik i kisik dobivaju se odlaganjem otpadne pare i procesne vode.
Mala potrošnja vode prilikom proizvodnje električne i toplinske energije.
Jednostavnost puta.
Značajne uštede energije kao troši se samo na zagrijavanje startera do uspostavljenog toplinskog režima.
Visoka produktivnost postupka, jer disocijacija molekula vode traje desetinke sekunde.
Eksplozija i požarna sigurnost metode, jer u njegovoj provedbi nisu potrebni spremnici za sakupljanje vodika i kisika.
Tijekom rada instalacije, voda se više puta pročišćava, pretvarajući se u destiliranu vodu. Time se uklanjaju sedimenti i kamenac, što povećava vijek trajanja instalacije.
Instalacija je izrađena od običnog čelika; osim kotlova izrađenih od čelika otpornih na toplinu s oblogom i oklopom njihovih zidova. Odnosno, nisu potrebni posebni skupi materijali.
Izum može naći primjenu u
industrijom zamjenom ugljikovodika i nuklearnog goriva u elektranama jeftinom, raširenom i ekološki prihvatljivom vodom, zadržavajući pritom snagu tih elektrana.
Vodik kod kuće: ima li koristi
Odmah napominjemo: neisplativo je koristiti generator vodika za grijanje kuće. Potrošit ćete više električne energije proizvodeći čisti H2 nego što ćete dobiti nakon što ga sagorite. Dakle, za 1 kW topline troši se 2 kW električne energije, odnosno nema koristi. Jednostavnije je instalirati bilo koji od električnih kotlova kod kuće.
Da biste zamijenili 1 litru benzina za automobil, trebat će vam 4766 litara čistog vodika ili 7150 litara plina oksihidrogena, od čega je 1/3 kisik. Do sada čak ni najbolji umovi na svijetu nisu razvili jedinicu sposobnu za takvu izvedbu.


ZAHTJEV
Metoda dobivanja vodika i kisika iz vodene pare
, uključujući propuštanje ove pare kroz električno polje, naznačeno time što koriste pregrijanu paru vode s temperaturom
500 - 550 o C
, prošao je kroz visokonaponsko električno polje istosmjerne struje da bi razdvojio paru i razdvojio je na atome vodika i kisika.
Odavno sam želio učiniti sličnu stvar. Ali daljnji eksperimenti s baterijom i parom elektroda nisu došli. Htio sam napraviti punopravni aparat za proizvodnju vodika, u količinama za napuhavanje balona. Prije izrade punopravnog aparata za elektrolizu vode kod kuće, odlučio sam provjeriti sve na modelu.
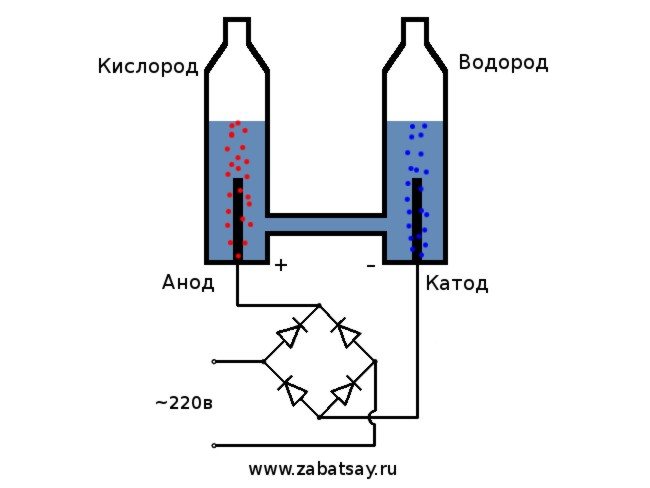
Opća shema elektrolizera izgleda ovako.

Ovaj model nije prikladan za potpunu svakodnevnu upotrebu. Ali uspjeli smo testirati ideju.
Zato sam odlučio koristiti grafit za elektrode. Izvrstan izvor grafita za elektrode je trolejbuski kolektor. Dosta ih je ležalo na krajnjim stanicama. Mora se zapamtiti da će se jedna od elektroda srušiti.


Vidjeli smo i finalizirali datotekom. Intenzitet elektrolize ovisi o jačini struje i površini elektroda.


Žice su pričvršćene na elektrode. Žice moraju biti pažljivo izolirane.


Za slučaj modela elektrolizera sasvim su prikladne plastične boce. U poklopcu za cijevi i žice izrađuju se rupe.


Sve je temeljito premazano brtvilom.


Odrezani grlovi boca prikladni su za spajanje dva spremnika.


Treba ih spojiti i šav se mora rastopiti.


Orašasti plodovi izrađeni su od čepova boca.


Rupe su izrađene u dvije boce na dnu. Sve je povezano i pažljivo ispunjeno brtvilom.


Kao izvor napona koristit ćemo mrežu kućanstva od 220 V. Želim vas upozoriti da je ovo prilično opasna igračka. Dakle, ako nemate dovoljno vještina ili postoje sumnje, onda je bolje ne ponavljati.U mreži kućanstva imamo izmjeničnu struju, za elektrolizu se ona mora ispraviti. Diodni most je savršen za to. Ona na fotografiji nije bila dovoljno moćna i brzo je izgorjela. Najbolja opcija bio je kineski diodni most MB156 u aluminijskom kućištu.


Diodni most se jako zagrijava. Trebat će aktivno hlađenje. Hladnjak za računalni procesor je savršen. Za kućište se može koristiti razvodna kutija prikladne veličine. Prodaje se u električnoj robi.


Nekoliko slojeva kartona mora se staviti ispod diodnog mosta.


U poklopcu razvodne kutije izrađuju se potrebne rupe.


Ovako izgleda sklopljena jedinica. Elektrolizator se napaja iz mreže, a ventilator napaja univerzalni izvor napajanja. Kao elektrolit koristi se otopina sode bikarbone. Ovdje se mora imati na umu da što je veća koncentracija otopine, to je veća brzina reakcije. Ali istodobno je i grijanje veće. Štoviše, reakcija razgradnje natrija na katodi pridonijet će zagrijavanju. Ova reakcija je egzotermna. Kao rezultat, stvorit će se vodik i natrijev hidroksid.


Uređaj na gornjoj fotografiji bio je vrlo vruć. Povremeno ga je trebalo isključiti i pričekati dok se ne ohladi. Problem zagrijavanja djelomično je riješen hlađenjem elektrolita. Za to sam koristio stolnu pumpu za fontanu. Duga cijev prolazi od jedne boce do druge kroz pumpu i kantu hladne vode.


Relevantnost ovog broja danas je prilično velika zbog činjenice da je sfera korištenja vodika izuzetno opsežna i u svom čistom obliku praktički se ne može naći nigdje u prirodi. Zbog toga je razvijeno nekoliko tehnika koje omogućuju ekstrakciju ovog plina iz drugih spojeva kemijskim i fizičkim reakcijama. O tome se govori u gornjem članku.
Dobivanje vodika i provjera čistoće
Vodik se može dobiti reakcijom cinka i klorovodične kiseline.
Zn + 2HCl = ZnCl2 + H2 ↑
Cink istiskuje vodik iz kiselina, poput svih metala koji stoje u nizu napona lijevo od vodika.
Da biste sakupili vodik u epruveti, trebate ga okrenuti naopako, jer je vodik lakši od zraka i teži prema gore. Ova metoda sakupljanja vodika naziva se "metoda istiskivanja zraka".
Sl. 1. Dobivanje vodika i prikupljanje istiskivanjem zraka
Epruveta akumulira vodik, ali sadrži i zrak, a time i kisik. Vodik i kisik eksplozivne su smjese. Prikupljeni vodik palimo iverjem. Epruveta je mala, a eksplozija vodika i kisika samo je oštar prasak. Što je u smjesi manje kisika, pamuk je tiši.
Ako je vodik prikupljen u epruveti čist, tada ćemo čuti tup skok. Takav se vodik može zapaliti.
Proizvodnja vodika u domaćinstvu
Izbor elektrolizera
Da biste dobili element kuće, potreban vam je poseban aparat - elektrolizator. Na tržištu postoji mnogo opcija za takvu opremu; uređaje nude i poznate tehnološke korporacije i mali proizvođači. Markirane jedinice su skuplje, ali je kvaliteta izrade viša.
Kućni aparat je mali i jednostavan za upotrebu. Njegovi su glavni detalji:
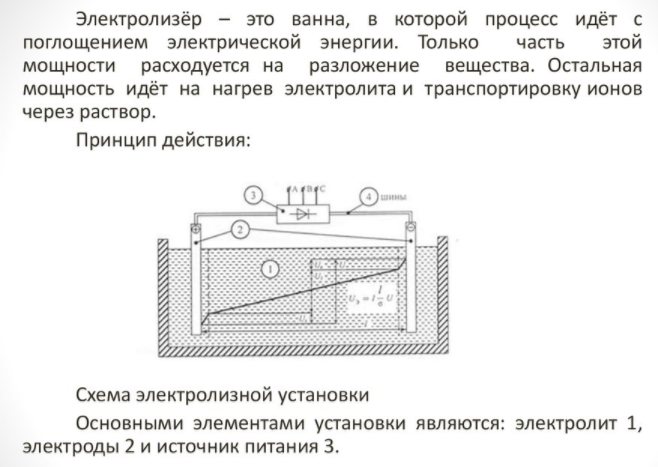

Elektrolizator - što je to
- reformator;
- sustav čišćenja;
- gorive ćelije;
- oprema za kompresore;
- spremnik za skladištenje vodika.
Jednostavna voda iz slavine uzima se kao sirovina, a električna energija dolazi iz redovnog otvora. Jedinice na solarni pogon štede na električnoj energiji.
Kućni se vodik koristi u sustavima grijanja ili kuhanja. Također obogaćuju smjesu goriva i zraka kako bi povećali snagu motora automobila.
Izrada aparata vlastitim rukama
Još je jeftinije napraviti uređaj sami kod kuće.Suha ćelija izgleda poput zapečaćene posude koja se sastoji od dvije ploče elektrode u spremniku s elektrolitskom otopinom. World Wide Web nudi razne sheme montaže za uređaje različitih modela:
- s dva filtra;
- s gornjim ili donjim rasporedom spremnika;
- s dva ili tri ventila;
- s pocinčanom pločom;
- na elektrodama.

Dijagram uređaja za elektrolizu
Nije teško stvoriti jednostavan uređaj za proizvodnju vodika. Trebat će:
- lim od nehrđajućeg čelika;
- prozirna cijev;
- okovi;
- plastična posuda (1,5 l);
- filtar za vodu i nepovratni ventil.
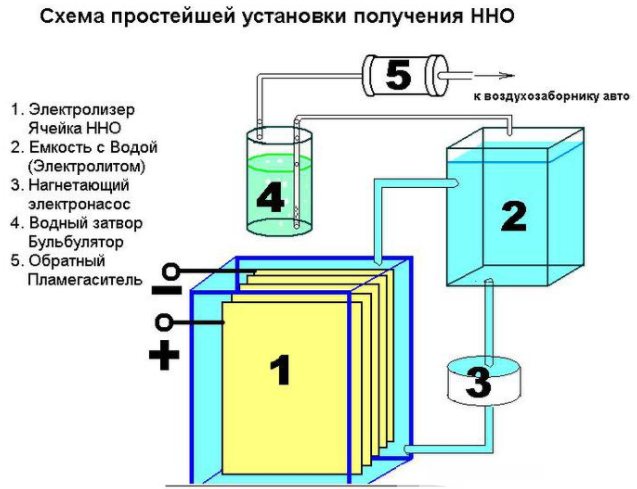

Uređaj jednostavnog uređaja za proizvodnju vodika
Osim toga, bit će potreban razni hardver: matice, podloške, vijci. Prvi korak je izrezati list na 16 četvrtastih odjeljaka, izrezati kut sa svakog od njih. U suprotnom kutu od njega morate izbušiti rupu za pričvršćivanje vijaka ploča. Da bi se osigurala konstantna struja, ploče moraju biti povezane prema shemi plus - minus - plus - minus. Ti su dijelovi međusobno izolirani cijevi, a na spoju vijkom i podloškama (tri dijela između ploča). Na plus i minus postavljeno je 8 ploča.
Kad su pravilno sastavljeni, rebra ploča neće dodirivati elektrode. Sastavljeni dijelovi spuštaju se u plastičnu posudu. Na mjestu gdje se zidovi dodiruju, dvije se rupe za pričvršćivanje izrađuju vijcima. Ugradite sigurnosni ventil za uklanjanje viška plina. Okovi su montirani u poklopac posude, a šavovi su zapečaćeni silikonom.
Ispitivanje aparata
Da biste testirali uređaj, izvedite nekoliko radnji:
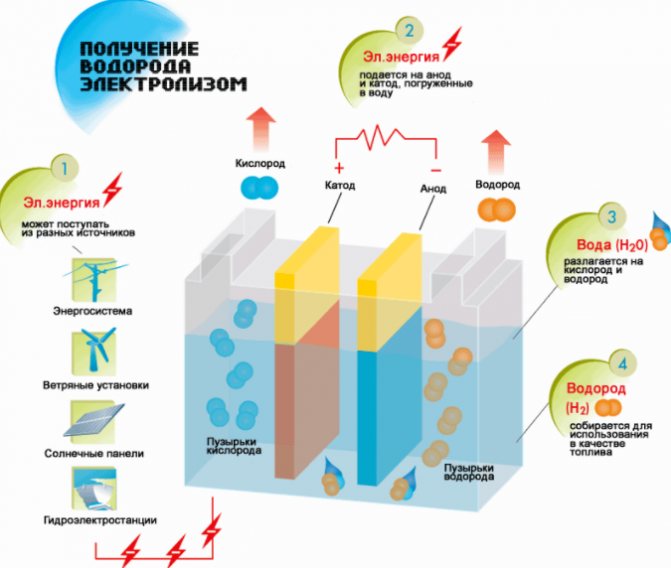

Shema proizvodnje vodika
- Napunite tekućinom.
- Pokrivajući poklopac, spojite jedan kraj cijevi na okov.
- Drugi je uronjen u vodu.
- Spojite na izvor napajanja.
Nakon uključivanja uređaja u utičnicu, nakon nekoliko sekundi bit će primjetni postupak elektrolize i oborine.
Čista voda nema dobru električnu vodljivost. Da biste poboljšali ovaj pokazatelj, trebate stvoriti elektrolitsku otopinu dodavanjem lužine - natrijevog hidroksida. Nalazi se u smjesama za čišćenje cijevi poput Mole.
Metode dobivanja vodika
Vodik je plinoviti element bez boje i mirisa gustoće 1/14 u odnosu na zrak. U slobodnom stanju to je rijetko. Obično se vodik kombinira s drugim kemijskim elementima: kisikom, ugljikom.
Proizvodnja vodika za industrijske potrebe i elektroenergetiku provodi se na nekoliko metoda. Najpopularniji su:
- elektroliza vode;
- metoda koncentracije;
- kondenzacija na niskoj temperaturi;
- adsorpcija.
Vodik se može izolirati ne samo iz plinovitih ili vodenih spojeva. Vodik se proizvodi izlaganjem drva i ugljena visokim temperaturama, kao i preradom biootpada.
Atomski vodik za energetiku dobiva se metodom toplinske disocijacije molekularne tvari na žici od platine, volframa ili paladija. Zagrijava se u atmosferi vodika pod tlakom manjim od 1,33 Pa. A također se radioaktivni elementi koriste za proizvodnju vodika.
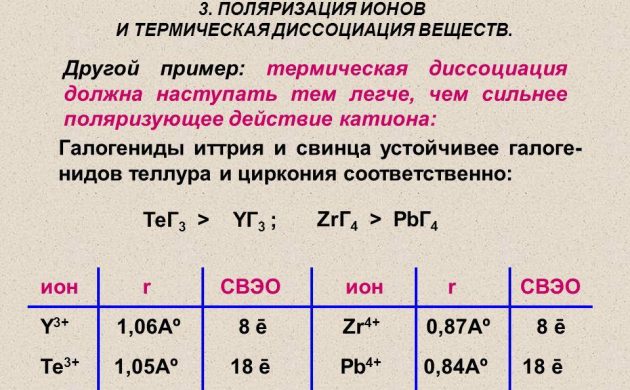

Toplinska disocijacija
Metoda elektrolize
Najjednostavnija i najpopularnija metoda evolucije vodika je elektroliza vode. Omogućuje proizvodnju praktički čistog vodika. Ostale prednosti ove metode su:
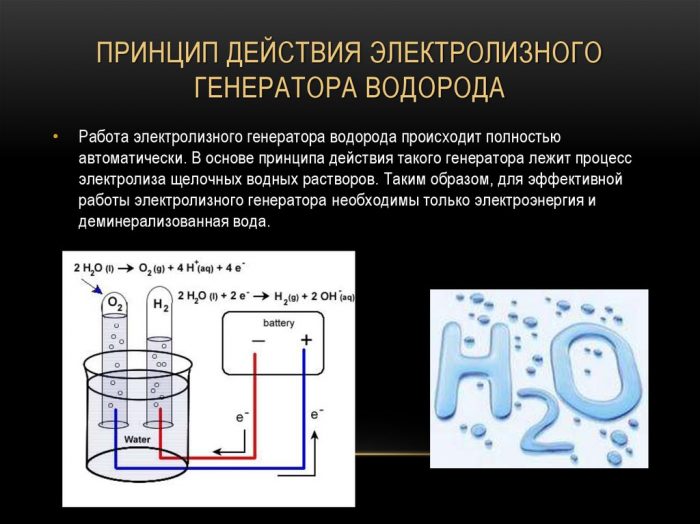

Načelo rada generatora elektrolize vodika
- dostupnost sirovina;
- primanje elementa pod pritiskom;
- sposobnost automatizacije procesa zbog nedostatka pokretnih dijelova.
Postupak cijepanja tekućine elektrolizom obrnut je od izgaranja vodika. Njegova je bit u tome što se pod utjecajem istosmjerne struje oslobađa kisik i vodik na elektrodama umočenim u vodenu otopinu elektrolita.
Dodatnom prednošću smatra se proizvodnja nusproizvoda s industrijskom vrijednošću.Stoga je potrebna velika količina kisika za kataliziranje tehnoloških procesa u energetskom sektoru, čišćenje tla i vodnih tijela i odlaganje kućnog otpada. Teška voda dobivena elektrolizom koristi se u energetici u nuklearnim reaktorima.
Proizvodnja vodika koncentracijom
Ova se metoda temelji na odvajanju elementa od plinskih smjesa koje ga sadrže. Dakle, najveći dio industrijski proizvedene tvari ekstrahira se pomoću parne reforme metana. Vodik koji se ekstrahira u ovom procesu koristi se u energetici, rafiniranju nafte, raketnoj industriji, kao i za proizvodnju dušičnih gnojiva. Postupak dobivanja H2 provodi se na različite načine:
- kratki ciklus;
- kriogeni;
- membrana.
Potonja metoda smatra se najučinkovitijom i jeftinijom.
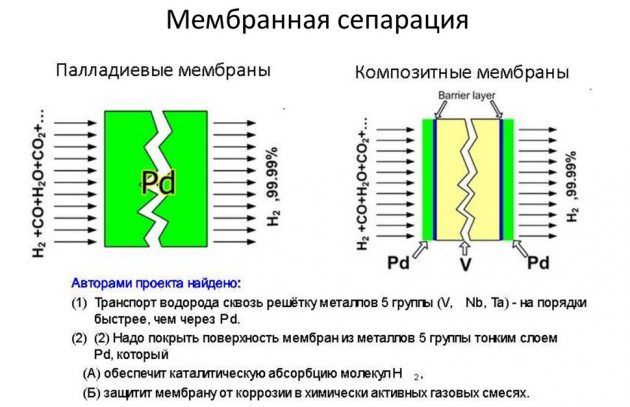

Kondenzacija na niskoj temperaturi
Ova metoda dobivanja H2 sastoji se u snažnom hlađenju plinovitih spojeva pod tlakom. Kao rezultat toga, oni se pretvaraju u dvofazni sustav, koji se potom separatorom odvaja u tekuću komponentu i plin. Za hlađenje se koriste tekući mediji:
- voda;
- ukapljeni etan ili propan;
- tekući amonijak.


Ovaj postupak nije tako jednostavan kao što zvuči. Neće biti moguće odvojiti plinove ugljikovodika odjednom. Neke će komponente otići s plinom koji se uzima iz odjeljka za odvajanje, što nije ekonomično. Problem se može riješiti dubokim hlađenjem sirovine prije odvajanja. Ali za to je potrebno puno energije.
U modernim niskotemperaturnim sustavima kondenzatora dodatno su osigurani stupovi za demetanizaciju ili deetanizaciju. Plinska faza uklanja se iz posljednjeg stupnja odvajanja, a tekućina se nakon izmjene topline šalje u destilacijski stupac s strujom sirovog plina.
Metoda adsorpcije
Tijekom adsorpcije za oslobađanje vodika koriste se adsorbenti - krute tvari koje apsorbiraju potrebne komponente mješavine plina. Kao adsorbenti koriste se aktivni ugljen, silikatni gel, zeoliti. Za provođenje ovog postupka koriste se posebni uređaji - ciklični adsorberi ili molekularna sita. Kada se primjenjuje pod tlakom, ova metoda može povratiti 85% vodika.
Usporedimo li adsorpciju s niskotemperaturnom kondenzacijom, možemo primijetiti niži materijalni i operativni trošak postupka - u prosjeku za 30 posto. Vodik se proizvodi adsorpcijom za energetiku i uz upotrebu otapala. Ova metoda omogućuje ekstrakciju 90 posto H2 iz plinske smjese i dobivanje konačnog proizvoda s koncentracijom vodika do 99,9%.