Salah satu daripada banyak proses fizikokimia yang banyak digunakan, baik dalam industri dan kehidupan seharian, adalah elektrolisis - pemilihan permukaan elektrod yang dihubungkan dengan sumber semasa yang diletakkan dalam larutan atau lebur, komponennya (logam tulen - aluminium, tembaga, gas, dan lain-lain). Pemasangan utama di mana proses ini berlaku adalah electrolyzer.

Elektrolisis
Apa itu elektrolisis
Electrolyzer adalah pemasangan khas yang digunakan untuk memisahkan penyusunnya dari larutan atau lebur.
Ciri utama elektrolyser adalah:
- Voltan operasi untuk satu elektrod berkisar antara 1.8 hingga 2.0 V;
- Kekuatan semasa - untuk proses normal proses elektrolisis, arus dibekalkan ke elektrod dengan nilai ciri ini dari 5 hingga 10 A;
- Bilangan elektrod - bilangan minimum elektrod adalah 2, maksimum dibatasi oleh ukuran pemasangan itu sendiri dan tujuannya;
- Dimensi elektrod - bukan batang karbon digunakan sebagai elektrod, tetapi plat logam, ukurannya ditentukan oleh tujuan pemasangan, ciri voltan arus dari arus yang dibekalkan ke plat;
- Jarak antara permukaan elektrod bercas bertentangan - jarak minimum antara plat elektrod mestilah sekurang-kurangnya 1.5 mm;
- Bahan elektrod - dalam elektrolisis moden, kepingan keluli tahan karat dengan nikel digunakan sebagai bahan untuk anod dan katod.
Ciri penting lain dari loji elektrolisis adalah penggunaan pemangkin.
Pemasangan sedemikian digunakan untuk tujuan berikut:
- Memperoleh gas oksidrogen, yang terdiri daripada campuran hidrogen dan oksigen (Brown's gas);
- Pengasingan aluminium tulen, magnesium, zink dari garamnya mencair;
- Penyucian air dari garam dan kekotoran terlarut di dalamnya;
- Penggunaan lapisan nipis nikel, zink yang menghalang kakisan pada permukaan bahagian logam;
- Pembasmian kuman produk makanan;
- Penulenan air sisa dari garam logam berat terlarut dan bahan berbahaya lain.
Penting! Platinum-elektrod yang terbuat dari besi biasa lebih jarang digunakan pada kilang elektrolisis daripada dari keluli tahan karat, kerana ia mengoksidasi lebih cepat dan menjadi tidak dapat digunakan.
Electrolyzer buatan sendiri
Sesiapa sahaja boleh membuat elektrolisis dengan tangan mereka sendiri. Untuk proses pemasangan reka bentuk yang paling biasa, bahan berikut akan diperlukan:
- kepingan keluli tahan karat (pilihan terbaik adalah AISI 316L asing atau 03X16H15M3 kami);
- selak М6х150;
- mesin basuh dan kekacang;
- tiub lutsinar - anda boleh menggunakan tahap semangat, yang digunakan untuk tujuan pembinaan;
- beberapa kelengkapan herringbone dengan diameter luar 8 mm;
- bekas plastik dengan isipadu 1.5 liter;
- penapis kecil air paip penapis, misalnya, penapis untuk mesin basuh;
- injap air tanpa pulangan.
Proses pemasangan
Kumpulkan electrolyzer dengan tangan anda sendiri mengikut arahan berikut:
- Pertama sekali, anda perlu menandakan dan menggergaji keluli tahan karat seterusnya menjadi petak yang sama. Gergaji boleh dilakukan dengan penggiling sudut (penggiling sudut). Salah satu sudut di petak sedemikian mesti dipotong pada sudut untuk mengikat plat dengan betul;
- Seterusnya, anda perlu membuat lubang untuk bolt di sisi plat yang bertentangan dengan potongan gergaji sudut;
- Sambungan plat hendaklah dilakukan secara bergilir: satu plat pada "+", yang seterusnya pada "-" dan seterusnya;
- Di antara plat yang berlainan cas harus ada penebat, yang berfungsi sebagai tiub dari tahap semangat.Ia harus dipotong menjadi cincin, yang harus dipotong memanjang untuk mendapatkan jalur ketebalan 1 mm. Jarak antara plat ini mencukupi untuk evolusi gas yang baik semasa elektrolisis;
- Plat diikat bersama menggunakan mesin basuh seperti berikut: mesin basuh duduk di selak, kemudian pinggan, kemudian tiga mesin basuh, selepas pinggan, dan sebagainya. Plat yang diisi dengan baik, diletakkan pada gambar cermin kepingan bermuatan negatif. Ini memungkinkan untuk mengelakkan tepi gergaji menyentuh elektrod;


Plat loji elektrolisis dipasang bersama
- Semasa memasang pinggan, anda harus mengasingkannya secara serentak dan mengetatkan kacang;
- Juga, setiap plat mesti dililit untuk memastikan bahawa tidak ada litar pintas;
- Selanjutnya, keseluruhan pemasangan mesti diletakkan di dalam kotak plastik;
- Selepas itu, perlu disoroti tempat-tempat di mana baut menyentuh dinding bekas, di mana anda menggerudi dua lubang. Sekiranya selak tidak masuk ke dalam bekas, maka perlu dipotong dengan gergaji besi;
- Kemudian selak diketatkan dengan mur dan mesin basuh untuk keketatan struktur;


Pinggan diletakkan di dalam bekas plastik
- Selepas langkah yang diambil, anda perlu membuat lubang di penutup bekas dan memasukkan kelengkapan ke dalamnya. Kebolehtelapan dalam kes ini dapat dipastikan dengan menutup sendi dengan sealant berasaskan silikon;
- Injap keselamatan dan penapis dalam struktur terletak di saluran keluar gas dan berfungsi sebagai alat untuk mengawal pengumpulan gas yang berlebihan, yang dapat menyebabkan hasil yang buruk;
- Unit elektrolisis dipasang.
Tahap terakhir adalah ujian, yang dilakukan dengan cara yang serupa:
- mengisi bekas dengan air hingga tanda bolt untuk pengikat;
- menyambungkan kuasa ke peranti;
- sambungan ke pemasangan tiub, hujung yang berlawanan diturunkan ke dalam air.
Sekiranya arus yang lemah dibekalkan ke pemasangan, maka pembebasan gas melalui tiub hampir tidak dapat dilihat, tetapi mungkin untuk menontonnya dari dalam elektrolisis. Dengan meningkatkan arus bolak-balik, menambahkan pemangkin alkali ke dalam air, hasil zat gas dapat meningkat dengan ketara.
Electrolyzer yang dibuat, sebagai peraturan, adalah bahagian penting dari banyak peranti, misalnya, pembakar hidrogen.


kemunculan pembakar hidrogen, yang asasnya dianggap sebagai elektrolisis buatan sendiri
Dengan mengetahui jenis, ciri utama, peranti dan prinsip kerja pemasangan ionik, anda dapat melakukan pemasangan struktur buatan sendiri yang betul, yang merupakan pembantu yang sangat baik dalam pelbagai situasi sehari-hari: mulai dari pengelasan dan penjimatan penggunaan bahan bakar kenderaan bermotor hingga fungsi sistem pemanasan.
Peranti dan prinsip operasi
Katod dan anod
Loji elektrolisis termudah terdiri daripada beberapa "sel", yang masing-masing merangkumi:
- 2 elektrod plat - katod (negatif) dan anod (positif);
- Gasket getah di sekitar perimeter dua elektrod berbeza yang berdekatan.
Sel luar dilengkapi dengan paip khas di mana gas yang dihasilkan dikeluarkan.
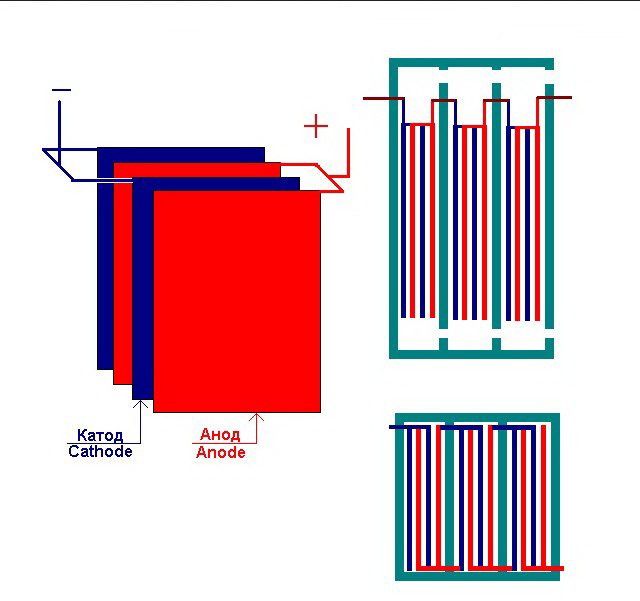

Beberapa "sel" yang saling berkaitan dari loji elektrolisis
Electrolyzer boleh mengandungi dari 1 hingga 30-40 atau lebih "sel" seperti itu, plat dengan nama yang sama disambungkan secara bersiri.
Penting! Semasa menggunakan bekalan kuasa dengan arus bolak, penerus juga digunakan, yang paling mudah adalah jambatan dioda.
Pemasangan sedemikian berfungsi seperti berikut:
- Air suling dengan alkali terlarut di dalamnya atau baking soda biasa dituangkan ke ruang antara elektrod;
- Voltan 1.8-2.0 V dibekalkan dari bekalan kuasa ke elektrod semua sel pemasangan;
- Hasil daripada proses elektrolisis, anion (ion bermuatan positif) zat terlarut dalam air tertarik pada katod bermuatan negatif, akibatnya terbentuknya filem natrium nipis di atasnya;
- Pada anod bermuatan positif, pemusnahan molekul air berlaku, dengan masing-masing terbentuk 2 atom hidrogen dan 1 atom oksigen;
- Gas peledak yang dilepaskan melalui paip cawangan memasuki bekas yang dimaksudkan untuknya.
Keamatan proses elektrolisis bergantung pada voltan dan kekuatan semasa - pada nilai rendah ciri-ciri ini, proses itu tidak akan diteruskan. Sekiranya sumber kuasa membekalkan arus dengan nilai yang terlalu tinggi dari ciri voltan arus, larutan yang dituangkan ke dalam elektrolisis akan sangat panas dan mendidih.
Penyahpepijatan dan pengujian peranti
Maka perlu untuk menentukan di mana baut menyentuh dinding kotak dan, di tempat-tempat itu, gerudi dua lubang. Sekiranya tanpa alasan yang jelas ternyata baut tidak masuk ke dalam bekas, maka ia harus potong dan ketatkan agar sesak dengan kacang... Sekarang anda perlu membuka penutup dan memasukkan penyambung berulir di sana dari kedua sisi. Untuk memastikan ketelapan, sendi harus ditutup dengan sealant berasaskan silikon.
Setelah memasang elektrolisis anda sendiri dengan tangan anda sendiri, anda harus mengujinya. Untuk melakukan ini, sambungkan peranti ke sumber kuasa, isi dengan air ke selak, pasangkan penutup dengan menyambungkan tiub ke pas dan menurunkan hujung tiub yang bertentangan ke dalam air. Sekiranya arus lemah, arus akan kelihatan dari dalam elektrolisis.
Secara beransur-ansur meningkatkan arus di perkakas buatan sendiri. Air suling tidak mengalirkan elektrik dengan baik kerana tidak mengandungi garam atau kekotoran. Untuk menyediakan elektrolit, perlu menambahkan alkali ke dalam air. Untuk melakukan ini, anda perlu mengambil natrium hidroksida (terdapat dalam pembersih paip jenis "Mole"). Injap keselamatan diperlukan untuk mengelakkan sejumlah besar gas terkumpul.
- Lebih baik menggunakan air suling dan soda sebagai pemangkin.
- Anda harus mencampurkan sedikit soda penaik dengan empat puluh bahagian air. Dinding di sisi terbuat dari kaca akrilik.
- Elektrod paling baik diperbuat daripada keluli tahan karat. Adalah masuk akal untuk menggunakan emas untuk pinggan.
- Gunakan PVC lut untuk sandaran. Mereka boleh berukuran 200 x 160 milimeter.
- Anda boleh menggunakan electrolyzer anda sendiri, yang dibuat sendiri, untuk memasak makanan, untuk pembakaran petrol sepenuhnya di dalam kereta dan dalam kebanyakan kes.
Elektrolisis kering terutamanya digunakan untuk mesin. Penjana meningkatkan kuasa enjin pembakaran. Hidrogen menyala lebih cepat daripada bahan bakar cair, meningkatkan daya omboh. Selain Mole, anda boleh mengambil Mister Muscle, soda kaustik, baking soda.
Penjana tidak berfungsi menggunakan air minuman. Lebih baik menyambungkan elektrik seperti ini: plat pertama dan terakhir - tolak, dan di plat di tengah - tambah. Semakin besar luas plat dan semakin kuat arus, semakin banyak gas dibebaskan.
Jenis elektrolisis
Kimpalan tempat DIY untuk bateri
Bergantung pada reka bentuk dan prinsip operasi, terdapat 5 jenis loji elektrolisis.
Keringkan
Elektrolisis ini terdiri daripada elektrod plat yang dipisahkan oleh gasket getah tertutup. Selalunya "sel" pemasangan juga ditempatkan dalam kandang tertutup.
Hidrogen dan oksigen yang dihasilkan akibat elektrolisis dikeluarkan melalui paip cawangan khas yang terletak di hujung badan atau plat pemasangan yang melampau.
Mengalir
Pemasangan elektrolisis jenis ini mempunyai peranti berikut:
- Mandi elektrolisis (badan) dengan dua muncung, melalui salah satu elektrolit dimasukkan ke dalamnya, melalui kedua gas peledak yang terbentuk akibat elektrolisis dikeluarkan;
- Elektrod plat dipisahkan oleh spacer;
- Sebuah tangki dengan elektrolit yang terletak di atas perumahan dengan elektrod dan dihubungkan oleh selang ke paip cawangan mandi elektrolisis pemasangan dan mempunyai paip cawangan dengan injap gas di bahagian atas.
Semasa operasi alat sedemikian, gas yang berevolusi melalui paip cawangan dan selang memasuki tangki dengan elektrolit dan, dengan mewujudkan tekanan tertentu di dalamnya, meninggalkan pemasangan melalui injap pada paip cawangan.
Membran
Sel elektrolisis pemasangan sedemikian terdiri daripada dua elektrod yang dipisahkan oleh membran nipis yang membolehkan produk elektrolisis melewati dan memisahkan elektrod antara satu sama lain.
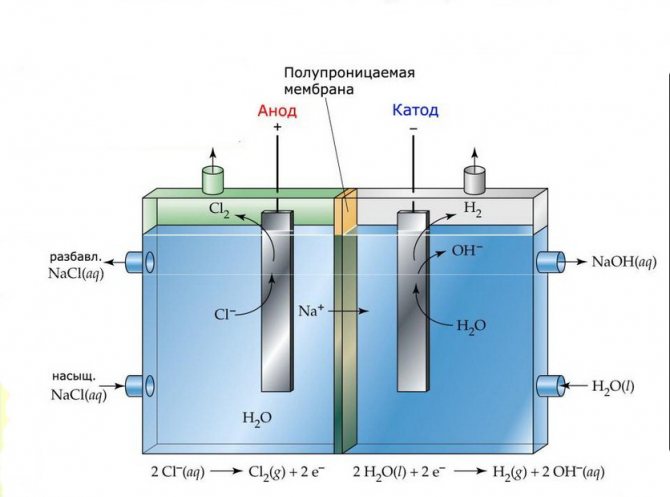

Loji elektrolisis membran
Diafragma
Pemasangan elektrolisis jenis ini terdiri daripada termos berbentuk "U" dengan dua elektrod dimasukkan ke dalamnya dan 2-3 diafragma yang tidak dapat ditembusi. Elektrolizer serupa digunakan untuk pengeluaran hidrogen dan oksigen tulen secara berasingan.
Beralkali
Tidak seperti model elektrolisis lain, larutan alkali digunakan sebagai soda kaustik elektrolit (natrium hidroksida), yang bukan hanya sumber hidrogen dan oksigen tambahan, tetapi juga pemangkin elektrolisis.


Litar elektrolisis alkali
Pemasangan seperti itu, berbeza dengan analog jenis lain, membolehkan penggunaan elektrod lebih murah yang diperbuat daripada besi biasa.
Lakukan elektrolisis dengan tangan anda sendiri
Pasti, anda sudah biasa dengan proses elektrolisis dari kurikulum sekolah rendah. Ini adalah ketika 2 elektrod kutub diletakkan di dalam air di bawah arus untuk mendapatkan logam atau bukan logam dalam bentuk tulennya. Elektrolisis diperlukan untuk menguraikan molekul air menjadi oksigen dan hidrogen. Elektrolisis, sebagai sebahagian daripada mekanisme saintifik, membahagikan molekul menjadi ion.
Terdapat dua jenis peranti ini:
- Elektrolisis kering (ini adalah sel yang ditutup sepenuhnya);
- Electrolyzer basah (ini adalah dua plat logam yang diletakkan di dalam bekas air).
Peranti ini mudah dari segi peranti, yang memungkinkan gunakan walaupun di rumah... Elektrolisis membahagi cas elektrolisis atom molekul menjadi atom yang dikenakan.
Dalam kes kita, ia membahagikan air menjadi hidrogen positif dan oksigen negatif. Untuk melakukan ini memerlukan sejumlah besar tenaga, dan untuk mengurangkan tenaga yang diperlukan, pemangkin digunakan.
Electrolyzer untuk pengeluaran hidrogen
Pengiraan pembumian
Untuk memasang elektrolisis termudah dengan tangan anda sendiri, anda boleh menggunakan gambar yang ditunjukkan dalam gambar.


Melukis elektrolisis buatan sendiri yang paling sederhana
Catatan! Electrolyzer adalah pemasangan yang agak berbahaya, yang, semasa operasi, gas oxyhydrogen, yang terkumpul dalam jumlah besar, dapat menyebabkan letupan serius. Unit tidak boleh diletakkan berhampiran sumber api terbuka, alat pemanasan.
Elektrolyser DIY untuk sebuah kereta
Untuk meningkatkan pembakaran bahan bakar dalam enjin kereta, elektrolisis sering dipasang, yang terdiri daripada kotak dari bateri lama dengan plat keluli tahan karat yang diletakkan di dalamnya, dua muncung, salah satunya disambungkan ke tangki yang diisi dengan elektrolit, yang kedua adalah disambungkan ke selang pembekal udara ke mesin (lebih tepatnya, dengan bergelombang dari pengambilan udara ke penapis udara).
Electrolyzer aliran buatan sendiri seperti itu digerakkan dari bateri kereta menggunakan relay dan sekering 10 A.
Kami membuat peranti dengan tangan kami sendiri
Peranti untuk proses ini boleh dilakukan dengan tangan.
Untuk ini, anda memerlukan:
- Lembaran keluli tahan karat;
- Selak M6 x 150;
- Mesin basuh;
- Kacang;
- Tiub lutsinar;
- Menghubungkan elemen dengan benang di kedua sisi;
- Bekas plastik satu setengah liter;
- Penapis air;
- Periksa injap untuk air.
Pilihan yang sangat baik untuk keluli tahan karat adalah AISI 316L pengeluar asing atau 03X16H15M3 pengeluar dari negara kita. Sama sekali tidak perlu membeli keluli tahan karat, anda boleh mengambil yang lama. 50 hingga 50 sentimeter sudah cukup untuk anda.
"Mengapa mengambil keluli tahan karat itu sendiri?" - anda bertanya. Oleh kerana logam yang paling biasa akan menghakis. Keluli tahan karat bertolak ansur dengan alkali dengan lebih baik. Sekiranya gariskan helaian sedemikian rupa sehingga membahagikannya kepada 16 petak serupa... Anda boleh memotongnya dengan penggiling sudut. Di setiap petak, potong salah satu sudut.
Di sudut lain dan sudut yang berlawanan, dari sudut gergaji, gerudi lubang untuk bolt yang akan membantu menahan plat bersama-sama. Electrolyzer tidak berhenti berfungsi seperti ini:elektrik t plat mengalir ke plat - dan air terurai menjadi oksigen dan hidrogen. Berkat ini, kami memerlukan plat yang baik dan negatif.
Plat mesti disambungkan secara bergantian: tambah-tolak-tambah-tolak, dengan kaedah yang serupa, akan ada arus yang kuat. Untuk melindungi plat satu dari satu, tiub digunakan. Sebentuk cincin dipotong dari aras. Dengan memotongnya, kita memperoleh ketebalan milimeter jalur. Jarak ini lebih tepat untuk membuat gas.
Platnya saling berkaitan dengan mesin basuh: kami meletakkan mesin basuh pada bolt, kemudian pinggan dan tiga mesin basuh, kemudian pinggan lagi, dan seterusnya. Pada nilai tambah dan tolak, lapan pinggan mesti ditanam. Sekiranya semuanya dilakukan dengan betul, maka potongan plat tidak akan menyentuh elektrod.
Kemudian anda perlu mengetatkan kacang dan mengasingkan pinggan. Kemudian kami meletakkan struktur di dalam bekas plastik.
Gambaran keseluruhan pengeluar electrolyzer
Pengeluar utama elektrolisis adalah perusahaan domestik (RUSAL, NPF RutTech, JSC Uralkhimmash), dan juga pesaing asing mereka - Teledyne Energy Systems, Inc (USA), Hydrogenics Corp. (Belgium).
Oleh itu, electrolyzer adalah pemasangan yang cukup mudah dan kaya dengan ciri yang digunakan untuk menghasilkan gas oxyhydrogen, yang pada masa depan dirancang untuk digunakan sebagai bahan bakar untuk mesin pembakaran dalaman dan dandang pemanasan.
Elektrolisis rumah sendiri
Semasa kecil, saya selalu mahu melakukan sesuatu dengan tangan saya sendiri. Tetapi ibu bapa (dan orang terdekat lain) tidak membenarkan perkara ini berlaku. Dan saya tidak melihat (dan sehingga sekarang saya tidak melihat) apa-apa yang buruk ketika anak-anak kecil ingin belajar ??
Sudah tentu, saya tidak menulis artikel ini untuk mengingat pengalaman zaman kanak-kanak dalam keinginan untuk memulakan pendidikan diri. Secara tidak sengaja, ketika saya melayari Internet, saya menemui soalan seperti ini. Beberapa budak pengebom kecil mengemukakan soalan mengenai bagaimana melakukan elektrolisis di rumah. Benar, saya tidak menjawabnya, kerana budak lelaki ini ingin mengolok-olokkan campuran mencurigakan yang menyakitkan itu ?? Saya memutuskan bahawa saya tidak akan mengatakan lebih jauh mengenai dosa, biarkan saya melihat sendiri buku-buku. Tetapi tidak lama dahulu, sekali lagi mengembara di forum, saya melihat soalan serupa dari seorang guru di sekolah kimia. Dilihat dari keterangannya, sekolahnya sangat miskin sehingga tidak dapat (tidak mahu) membeli mesin elektrolisis dengan harga 300 rubel. Guru (apa masalahnya!) Tidak dapat mencari jalan keluar dari situasi yang dihasilkan. Oleh itu, saya menolongnya. Bagi mereka yang ingin tahu mengenai produk buatan sendiri seperti ini, saya menyiarkan artikel ini di laman web.
Sebenarnya, proses pengeluaran dan penggunaan palet diri kita sangat primitif. Tetapi saya akan memberitahu anda mengenai keselamatan terlebih dahulu, dan mengenai pembuatan - pada yang kedua. Maksudnya ialah kita bercakap mengenai elektrolisis demonstrasi, dan bukan mengenai kilang industri. Terima kasih kepada ini, untuk keselamatan, adalah baik untuk mengaktifkannya bukan dari rangkaian, tetapi dari bateri AA atau dari bateri. Secara semula jadi, semakin tinggi voltan, semakin cepat proses elektrolisis berjalan. Walau bagaimanapun, untuk pemerhatian visual gelembung gas, ia cukup cukup 6 V, tetapi 220 sudah berlebihan. dengan voltan sedemikian, air, misalnya, akan mendidih paling cepat, dan ini tidak begitu selamat ... Baiklah, saya rasa anda sudah mengetahui ketegangan?
Sekarang mari kita bincangkan di mana dan dalam keadaan apa kita akan bereksperimen. Perkara pertama, ruang kosong atau bilik berventilasi baik. Walaupun saya melakukan semuanya di sebuah apartmen dengan tingkap tertutup dan tidak seperti itu? Kedua, percubaan paling baik dilakukan di atas meja yang bagus. Perkataan "baik" bermaksud bahawa meja mesti stabil, dan lebih baik berat, kaku dan melekat pada permukaan lantai. Dalam kes ini, penutup meja mestilah tahan terhadap bahan yang agresif. By the way, jubin dari jubin sangat sesuai untuk ini (walaupun tidak setiap, sayangnya). Jadual seperti ini akan berguna bukan hanya untuk pengalaman ini. Namun, saya melakukan semuanya dengan najis biasa ?? Ketiga, semasa percubaan, anda tidak perlu mengalihkan sumber kuasa (dalam kes saya, bateri). Oleh kerana itu, untuk kebolehpercayaan, sebaiknya segera meletakkannya di atas meja dan membetulkannya agar tidak berganjak. Percayalah, ini lebih senang daripada memegangnya dengan tangan dengan kerap. Saya hanya mengikat bateri saya sendiri dengan pita elektrik ke objek keras pertama yang saya lihat. Keempat, hidangan di mana kita akan bereksperimen, biarkan ia kecil. Kaca sederhana sesuai atau kaca tembakan. By the way, ini adalah kaedah yang paling optimum untuk menggunakan gelas di rumah, berbanding dengan menuangkan alkohol ke dalamnya dengan penggunaan selanjutnya ...
Baiklah, sekarang mari beralih secara khusus ke peranti. Ia disediakan dalam gambar, tetapi buat masa ini saya akan menerangkan secara ringkas apa dan apa.
Kita perlu mengambil pensil sederhana dan mengeluarkan pokok itu dengan pisau biasa dan mengeluarkan keseluruhan pensil. Anda boleh mengambil pensil mekanikal. Tetapi ada dua kesukaran sekaligus. Yang pertama adalah yang biasa. Plumbum dari pensil mekanikal terlalu nipis, bagi kita ini tidak sesuai untuk percubaan visual. Kesukaran kedua adalah sebilangan komposisi yang tidak dapat difahami dari papan tulis semasa. Rasanya seperti itu tidak dibuat dari grafit, tetapi dari yang lain. Secara umum, pengalaman saya dengan "plumbum" seperti itu sama sekali tidak berjaya, walaupun pada voltan 24 V. Berkat ini, saya perlu memilih pensil sederhana berkayu yang bagus. Batang grafit yang dihasilkan akan berfungsi sebagai elektrod bagi kita. Seperti yang anda bayangkan, kita memerlukan dua elektrod. Berkat ini, kita memilih pensil kedua, atau hanya memecahkan batang yang ada menjadi dua. Saya sebenarnya melakukan ini.
Dengan wayar yang ada di tangan, kami membungkus elektrod plumbum pertama (dengan satu hujung wayar), dan kami menyambungkan wayar ini ke tolak sumber kuasa (dengan hujung yang lain). Kemudian kami mendahului kedua dan melakukan perkara yang sama dengannya. Untuk ini, berdasarkan ini, kita memerlukan wayar kedua. Tetapi dalam kes ini, kami menyambungkan wayar ini dengan kelebihan bekalan kuasa. Sekiranya anda menghadapi masalah memasang batang grafit rapuh ke wayar, anda boleh menggunakan alat yang ada di tangan, seperti pita atau pita saluran. Sekiranya tidak berjaya membungkus hujung grafit dengan wayar itu sendiri, dan pita penebat atau pita penebat tidak memberikan sentuhan yang ketat, maka cubalah merekatkan plumbum dengan gam konduktif. Sekiranya anda tidak mempunyai ini, sekurang-kurangnya ikatkan kabel ke wayar dengan benang. Tidak perlu takut, benang tidak akan terbakar dari ketegangan seperti itu ??
Bagi mereka yang tidak mengetahui apa-apa mengenai bateri dan peraturan mudah untuk menyambungkannya, saya akan menerangkan sedikit. Bateri jenis jari menghasilkan voltan 1.5 V. Dalam gambar saya mempunyai dua bateri yang serupa. Lebih-lebih lagi, mereka berhubung secara beransur-ansur - satu demi satu, tidak selari. Dengan sambungan yang sama (bersiri), voltan akhir akan dijumlahkan dari voltan setiap bateri, iaitu bagi saya ia adalah 1.5 + 1.5 = 3.0 V. Ini kurang daripada 6 volt yang dinyatakan sebelumnya. Tetapi saya terlalu malas untuk membeli beberapa bateri lagi. Prinsip anda dan begitu mesti jelas ??
Mari mulakan percubaan. Sebagai contoh, kita akan mengehadkan elektrolisis air.Pertama, sangat mudah diakses (saya harap pembaca artikel ini tidak tinggal di Sahara), dan kedua, ia tidak berbahaya. Lebih-lebih lagi, saya akan menunjukkan bagaimana dengan alat yang sama (electrolyzer) dengan bahan yang sama (air) untuk melakukan dua pelbagai pengalaman. Saya rasa anda mempunyai daya imaginasi yang cukup untuk menghasilkan banyak eksperimen serupa dengan bahan lain ?? Secara amnya, air paip sesuai untuk kita. Tetapi saya mengesyorkan agar anda menambahkan sedikit lagi dan garamnya. Sedikit - ini bermaksud secubit kecil, bukan sudu pencuci mulut keseluruhan. Ini sangat penting! Kacau garam hingga larut. Jadi air, sebagai dielektrik dalam keadaan tulen, akan mengalirkan elektrik dengan sempurna. pada awal eksperimen, lap meja dari kelembapan yang berpotensi, dan kemudian letakkan sumber kuasa dan segelas air di atasnya.
Kami menurunkan kedua elektrod, yang terdapat di bawah voltan, ke dalam air. Pada masa yang sama, pastikan bahawa hanya grafit yang direndam di dalam air, dan wayar itu sendiri tidak boleh menyentuh air. Permulaan percubaan mungkin ditangguhkan. Masa bergantung pada banyak petunjuk: pada komposisi air, kualiti wayar, kualiti grafit dan, tentu saja, voltan sumber kuasa. Permulaan reaksi saya ditangguhkan selama beberapa saat. Oksigen mula berkembang pada elektrod yang disambungkan ke tambah bateri. Hidrogen akan dilepaskan pada elektrod yang disambungkan ke tolak. Harus diingat bahawa terdapat lebih banyak gelembung hidrogen. Gelembung yang sangat kecil melekat di bahagian grafit yang terendam di dalam air. Kemudian beberapa gelembung mula melayang.
Elektrod pada awal eksperimen. Masih belum ada gelembung gas. Gelembung hidrogen terbentuk pada elektrod yang disambungkan ke kutub negatif bateri
Apa eksperimen lain yang boleh dilakukan? Sekiranya anda sudah cukup bermain dengan hidrogen dan oksigen, kami meneruskan percubaan lain. Ia lebih menarik, terutama bagi penyelidik di rumah. Menarik kerana bukan sahaja dapat melihatnya, tetapi juga dapat menciumnya. Pada pengalaman lalu, kami menerima oksigen dan hidrogen, yang, pada pendapat saya, tidak begitu hebat. Dan dalam eksperimen lain, kita memperoleh dua bahan (berguna dalam kehidupan seharian, dengan cara itu). pada awal eksperimen, hentikan eksperimen sebelumnya dan keringkan elektrod. Sekarang ambil garam meja (yang biasanya anda gunakan di ruang dapur) dan larutkan dalam jisim air. Dalam kes ini, bukan sedikit. Sebenarnya, jumlah garam yang baik adalah satu-satunya perkara yang menjadikan pengalaman kedua berbeza daripada yang pertama. Setelah melarutkan garam, anda boleh mengulangi percubaan dengan segera. Sekarang reaksi yang berbeza sedang berlaku. Pada elektrod yang baik, bukan oksigen yang dibebaskan sekarang, tetapi klorin. Dan pada negatifnya, hidrogen juga dilepaskan. Adapun kaca di mana larutan garam berada, natrium hidroksida kekal di dalamnya setelah elektrolisis berpanjangan. Ini adalah soda kaustik, alkali.
Klorin, anda akan dapat menciumnya. Tetapi untuk kesan terbaik, saya cadangkan mengambil voltan sekurang-kurangnya 12 V. Jika tidak, anda mungkin tidak merasakan aromanya. Kehadiran alkali (setelah elektrolisis yang sangat lama) di dalam gelas dapat diperiksa dengan beberapa cara. Yang paling mudah dan ganas adalah meletakkan tangan anda di dalam gelas. Etnik etnik mengatakan bahawa jika sensasi terbakar bermula, terdapat alkali di dalam gelas. Cara yang lebih bijak dan berbeza adalah ujian litmus. Sekiranya sekolah anda sangat miskin sehingga tidak dapat memperoleh litmus, anda akan dibantu oleh petunjuk yang berguna. Salah satunya, seperti yang mereka katakan, boleh berfungsi sebagai setetes jus bit ?? Tetapi sangat mungkin untuk meneteskan sedikit lemak ke dalam penyelesaiannya. Setahu saya, penyapuan harus berlaku.
Untuk yang sangat ingin tahu, saya akan menerangkan apa yang sebenarnya berlaku semasa eksperimen. Dalam eksperimen pertama, di bawah pengaruh arus elektrik, reaksi serupa berlaku: 2 H2O >>> 2 H2 + O2 Kedua-dua gas secara semula jadi terapung dari air ke permukaan. By the way, gas terapung dapat terperangkap. Adakah anda akan dapat melakukannya sendiri?
Dalam eksperimen lain, tindak balasnya sama sekali berbeza.Ia juga dimulakan oleh arus elektrik, tetapi sekarang bukan hanya air, tetapi juga garam bertindak sebagai reagen: 4H2O + 4NaCl >>> 4NaOH + 2H2 + 2Cl2 Perlu diingat bahawa tindak balas mesti berlaku pada lebihan air. Untuk mengetahui jumlah garam yang dianggap paling besar, anda boleh mengiranya dari reaksi di atas. Anda masih boleh memikirkan cara memperbaiki peranti atau percubaan lain yang boleh dilakukan. Betul, natrium hipoklorit dapat diperoleh dengan elektrolisis. Dalam keadaan makmal, dalam kebanyakan kes, ia diperoleh dengan mengalirkan klorin gas melalui larutan natrium hidroksida.