Een van de vele fysisch-chemische processen die een brede toepassing hebben gevonden, zowel in de industrie als in het dagelijks leven, is elektrolyse - de selectie op de oppervlakken van elektroden die zijn aangesloten op een stroombron die in een oplossing of smelt is geplaatst, hun componenten (puur metaal - aluminium, koper, gas, etc.). De belangrijkste installatie waarin dit proces plaatsvindt, is een elektrolyse-inrichting.

Elektrolyseur
Wat is een elektrolyser
Een elektrolyse-inrichting is een speciale installatie die wordt gebruikt om de bestanddelen uit een oplossing of smelt te scheiden.
De belangrijkste kenmerken van de elektrolyser zijn:
- De bedrijfsspanning voor één elektrode varieert van 1,8 tot 2,0 V;
- Stroomsterkte - voor het normale verloop van het elektrolyseproces wordt een stroom geleverd aan de elektroden met een waarde van deze eigenschap van 5 tot 10 A;
- Aantal elektroden - het minimumaantal elektroden is 2, het maximum wordt beperkt door de grootte van de installatie zelf en het doel ervan;
- Afmetingen van elektroden - geen koolstofstaven worden als elektroden gebruikt, maar metalen platen, waarvan de grootte wordt bepaald door het doel van de installatie, de stroom-spanningskarakteristiek van de stroom die aan de platen wordt geleverd;
- Afstand tussen tegengesteld geladen elektrode-oppervlakken - de minimale afstand tussen de elektrodeplaten moet minimaal 1,5 mm zijn;
- Elektrodemateriaal - in moderne elektrolyse-apparaten wordt roestvrijstalen plaat met nikkel gebruikt als materiaal voor de anode en kathode.
Een ander belangrijk kenmerk van een elektrolyse-installatie is het gebruik van katalysatoren.
Dergelijke installaties worden gebruikt voor de volgende doeleinden:
- Het verkrijgen van een knalgas, bestaande uit een mengsel van waterstof en zuurstof (Brown's gas);
- Isolatie van zuiver aluminium, magnesium, zink uit hun zoutsmeltingen;
- Zuivering van water uit zouten en daarin opgeloste onzuiverheden;
- Aanbrengen van een dunne laag nikkel, zink die corrosie op het oppervlak van metalen onderdelen voorkomt;
- Desinfectie van voedingsproducten;
- Zuivering van afvalwater uit opgeloste zouten van zware metalen en andere schadelijke stoffen.
Belangrijk! Platina-elektrode gemaakt van gewoon ijzer wordt minder vaak gebruikt in elektrolyse-installaties dan van roestvrij staal, omdat het sneller oxideert en onbruikbaar wordt.
Zelfgemaakte elektrolyseur
Iedereen kan met zijn eigen handen een elektrolyseur maken. Voor het montageproces van het meest voorkomende ontwerp zijn de volgende materialen nodig:
- roestvrijstalen plaat (de beste opties zijn buitenlandse AISI 316L of de onze 03X16H15M3);
- bouten М6х150;
- ringen en moeren;
- transparante buis - u kunt een waterpas gebruiken, die wordt gebruikt voor constructiedoeleinden;
- verschillende visgraatfittingen met een buitendiameter van 8 mm;
- plastic container met een inhoud van 1,5 liter;
- een klein filter dat leidingwater filtert, bijvoorbeeld een filter voor wasmachines;
- terugslagklep.
montageproces
Verzamel de elektrolyseur met uw eigen handen volgens de volgende instructies:
- Allereerst moet u de roestvrijstalen plaat markeren en vervolgens in identieke vierkanten zagen. Zagen kan met een haakse slijper (haakse slijper). Een van de hoeken in dergelijke vierkanten moet schuin worden afgesneden om de platen correct te bevestigen;
- Vervolgens moet u een gat maken voor de bout aan de zijkant van de plaat tegenover de hoekzaagsnede;
- De aansluiting van de platen moet beurtelings gebeuren: een plaat op "+", de volgende op "-" enzovoort;
- Tussen de verschillend geladen platen moet een isolator zitten, die als een buis vanaf de waterpas fungeert.Het moet in ringen worden gesneden, die in de lengte moeten worden gesneden om stroken van 1 mm dikte te verkrijgen. Deze afstand tussen de platen is voldoende voor een goede gasontwikkeling tijdens elektrolyse;
- De platen worden als volgt aan elkaar vastgemaakt met behulp van ringen: een ring zit op de bout, dan een plaat, dan drie ringen, na een plaat, enzovoort. Gunstig geladen platen worden in spiegelbeeld van negatief geladen platen geplaatst. Hierdoor kan worden voorkomen dat de gezaagde randen de elektroden raken;


Platen van de elektrolyse-installatie in elkaar gezet
- Bij het monteren van de platen moet u ze tegelijkertijd isoleren en de moeren vastdraaien;
- Ook moet elke plaat worden geringd om er zeker van te zijn dat er geen kortsluiting is;
- Verder moet het hele samenstel in een plastic doos worden geplaatst;
- Daarna is het de moeite waard om de plaatsen te markeren waar de bouten de wanden van de container raken, waar u twee gaten boort. Als de bouten niet in de container passen, moeten ze met een ijzerzaag worden gesneden;
- Vervolgens worden de bouten vastgedraaid met moeren en ringen voor de strakheid van de constructie;


Borden geplaatst in een plastic container
- Na de genomen stappen moet u gaten in het deksel van de container maken en de fittingen erin steken. De ondoordringbaarheid kan in dit geval worden verzekerd door de voegen af te dichten met siliconenkitten;
- Een veiligheidsklep en filter in de constructie bevinden zich aan de uitlaat van het gas en dienen als middel om overmatige gasophoping te beheersen, wat tot slechte resultaten kan leiden;
- De elektrolyse-eenheid is gemonteerd.
De laatste fase is een test, die op een vergelijkbare manier wordt uitgevoerd:
- het vullen van de container met water tot het merkteken van de bouten voor bevestigingsmiddelen;
- stroom aansluiten op het apparaat;
- verbinding met de fitting van de buis, waarvan het andere uiteinde in het water wordt neergelaten.
Als er een zwakke stroom op de installatie wordt toegepast, is het vrijkomen van gas door de buis bijna onmerkbaar, maar het is mogelijk om het van binnenuit in de elektrolyseur te bekijken. Door de wisselstroom te verhogen en een alkalische katalysator aan het water toe te voegen, is het mogelijk om de opbrengst van de gasvormige stof aanzienlijk te verhogen.
De gemaakte elektrolyseur is in de regel een belangrijk onderdeel van veel apparaten, bijvoorbeeld een waterstofbrander.


het uiterlijk van een waterstofbrander, waarvan de basis wordt beschouwd als een zelfgemaakte elektrolyseur
Als u de typen, de belangrijkste kenmerken, het apparaat en het werkingsprincipe van ionische installaties kent, kunt u de juiste montage van een zelfgemaakte constructie uitvoeren, wat een uitstekende assistent is in verschillende alledaagse situaties: van lassen en brandstofbesparing van motorvoertuigen tot de werking van verwarmingssystemen.
Apparaat en werkingsprincipe
Kathode en anode
De eenvoudigste elektrolyse-installatie bestaat uit verschillende "cellen", elk met:
- 2 plaatelektroden - kathode (negatief) en anode (positief);
- Een rubberen pakking rond de omtrek van twee aangrenzende ongelijke elektroden.
De buitenste cellen zijn uitgerust met speciale leidingen waardoor de ontwikkelde gassen worden afgevoerd.
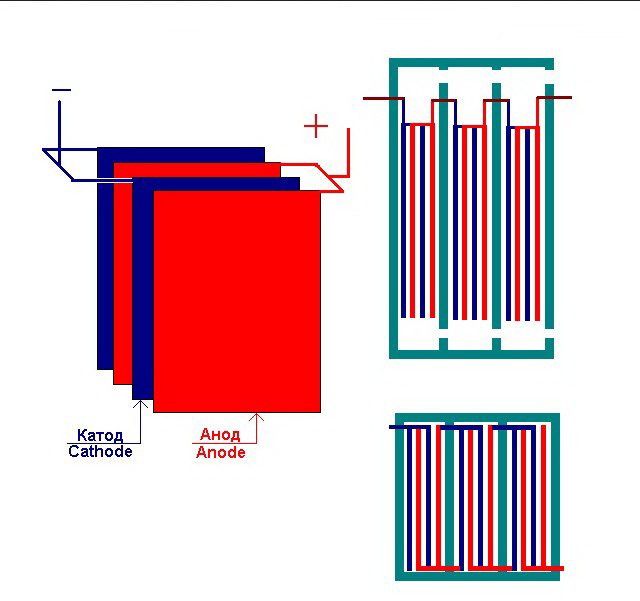

Meerdere onderling verbonden "cellen" van de elektrolyse-installatie
De electrolyzer kan 1 tot 30-40 of meer van dergelijke "cellen" bevatten, de gelijknamige platen zijn in serie geschakeld.
Belangrijk! Bij het gebruik van voedingen met wisselstroom worden aanvullend gelijkrichters gebruikt, waarvan de eenvoudigste een diodebrug is.
Zo'n installatie werkt als volgt:
- Gedestilleerd water met daarin opgelost alkali of gewoon zuiveringszout wordt in de ruimte tussen de elektroden gegoten;
- Een spanning van 1,8-2,0 V wordt geleverd vanuit de voeding naar de elektroden van alle cellen van de installatie;
- Door het elektrolyseproces worden anionen (positief geladen ionen) van een in water opgeloste stof aangetrokken door de negatief geladen kathode, waardoor daarop een dunne natriumfilm wordt gevormd;
- Op een positief geladen anode vindt de vernietiging van watermoleculen plaats, met elk gevormd 2 waterstofatomen en 1 zuurstofatoom;
- Het vrijkomende explosiegas via de aftakleidingen komt de daarvoor bestemde container binnen.
De intensiteit van het elektrolyseproces hangt af van de spanning en stroomsterkte - bij lage waarden van deze kenmerken gaat het proces niet door. Als de stroombron een stroom levert met te hoge waarden van de stroom-spanningskarakteristiek, zal de oplossing die in de elektrolyseur wordt gegoten erg heet zijn en wegkoken.
Foutopsporing en testen van het apparaat
Vervolgens moet worden bepaald waar de bouten de wanden van de doos raken en op die plaatsen twee gaten boren. Als zonder aanwijsbare reden blijkt dat de bouten niet in de container passen, dan zouden ze dat moeten doen knip en draai vast met moerenNu moet u het deksel eruit boren en de schroefdraadverbindingen daar van beide kanten plaatsen. Om ondoordringbaarheid te garanderen, moet de voeg worden afgedicht met een siliconenkit.
Nadat u uw eigen elektrolyseur met uw eigen handen heeft samengesteld, moet u deze testen. Sluit hiervoor het apparaat aan op een voedingsbron, vul het met water tot aan de bouten, doe het deksel op door een buis op de fitting te bevestigen en het andere uiteinde van de buis in het water te laten zakken. Als de stroom zwak is, is de stroom zichtbaar van binnenuit de elektrolyseur.
Verhoog geleidelijk de stroom in uw zelfgemaakte apparaat. Gedestilleerd water geleidt elektriciteit niet goed omdat het geen zouten of onzuiverheden bevat. Om de elektrolyt te bereiden, is het noodzakelijk om alkali aan het water toe te voegen. Om dit te doen, moet u natriumhydroxide nemen (in middelen voor het reinigen van leidingen zoals "Mole"). Een veiligheidsklep is nodig om te voorkomen dat een behoorlijke hoeveelheid gas zich ophoopt.
- Het is beter om gedestilleerd water en soda als katalysator te gebruiken.
- Je moet een deel van het zuiveringszout mengen met veertig delen water. De wanden aan de zijkanten zijn het beste van acrylglas.
- De elektroden zijn het beste gemaakt van roestvrij staal. Het is logisch om goud te gebruiken voor borden.
- Gebruik doorschijnend PVC als rug. Ze kunnen 200 bij 160 millimeter groot zijn.
- U kunt uw eigen elektrolyse-inrichting, die u zelf hebt gemaakt, gebruiken om voedsel te koken, voor de volledige verbranding van benzine in auto's en in de meeste gevallen.
Droge elektrolyse-apparaten worden voornamelijk gebruikt voor machines. De generator verhoogt het vermogen van de verbrandingsmotor. Waterstof ontsteekt veel sneller dan vloeibare brandstof, waardoor de kracht van de zuiger toeneemt. Naast Mole kunt u Mister Muscle, bijtende soda, baking soda gebruiken.
De generator werkt niet op drinkwater. Het is beter om elektriciteit op deze manier aan te sluiten: de eerste en de laatste plaat - minus, en op de plaat in het midden - plus. Hoe groter het oppervlak van de platen en hoe sterker de stroom, hoe meer gas er vrijkomt.
Soorten elektrolyse-apparaten
DIY puntlassen voor accu's
Afhankelijk van het ontwerp en het werkingsprincipe zijn er 5 soorten elektrolyse-installaties.
Droog
Dergelijke elektrolyse-apparaten bestaan uit plaatelektroden die zijn gescheiden door afgedichte rubberen pakkingen. Vaak worden de "cellen" van de installatie bovendien in een afgesloten behuizing geplaatst.
Waterstof en zuurstof gegenereerd als gevolg van elektrolyse worden verwijderd via speciale aftakleidingen aan het einde van het lichaam of de uiterste platen van de installatie.
Vloeiend
Dergelijke elektrolyse-installaties hebben de volgende inrichting:
- Een elektrolysebad (lichaam) met twee spuitmonden, waardoor er één elektrolyt in wordt geleid, door het tweede wordt het door elektrolyse gevormde ontstekingsgas afgevoerd;
- Plaatelektroden gescheiden door afstandhouders;
- Een tank met elektrolyt bevindt zich boven de behuizing met elektroden en is door middel van slangen verbonden met de aftakleidingen van het elektrolysebad van de installatie en heeft een aftakleiding met een gasklep in het bovenste gedeelte.
Tijdens de werking van een dergelijke inrichting komt het vrijkomende gas door de aftakleiding en de slang de tank binnen met de elektrolyt en, waardoor er een bepaalde druk in ontstaat, verlaat het de installatie via de klep op de aftakleiding.
Membraan
De elektrolysecellen van dergelijke installaties bestaan uit twee elektroden gescheiden door een dun membraan dat elektrolyseproducten doorlaat en de elektroden van elkaar scheidt.
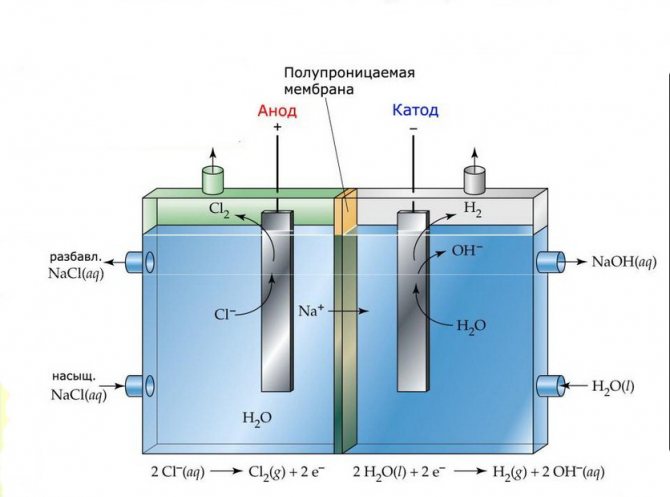

Membraan-elektrolyse-installatie
Diafragma
Elektrolyse-installaties van dit type bestaan uit een "U" -vormige kolf met twee elektroden erin en 2-3 ondoordringbare membranen. Vergelijkbare elektrolyse-apparaten worden gebruikt voor de gescheiden productie van zuivere waterstof en zuurstof.
Alkalisch
In tegenstelling tot andere modellen van elektrolyse-apparaten, wordt in deze een alkali-oplossing gebruikt als een elektrolyt - natronloog (natriumhydroxide), dat niet alleen een extra bron van waterstof en zuurstof is, maar ook een katalysator voor elektrolyse.


Alkaline elektrolyser circuit
Dergelijke installaties maken, in tegenstelling tot analogen van andere typen, het gebruik van goedkopere elektroden van gewoon ijzer mogelijk.
Doe de elektrolyser met uw eigen handen
U kent het elektrolyseproces vast wel uit het curriculum van de basisschool. Dit is wanneer 2 polaire elektroden onder stroom in water worden geplaatst om metalen of niet-metalen in hun zuivere vorm te verkrijgen. Er is een elektrolysator nodig om watermoleculen af te breken tot zuurstof en waterstof. De elektrolyseur, als onderdeel van wetenschappelijke mechanismen, verdeelt moleculen in ionen.
Er zijn twee soorten van dit apparaat:
- Droge elektrolyseur (dit is een volledig gesloten cel);
- Natte elektrolyse-inrichting (dit zijn twee metalen platen die in een bak met water zijn geplaatst).
Dit apparaat is eenvoudig qua apparaat, wat het mogelijk maakt zelfs thuis gebruikenElectrolyzers verdelen de elektrolyse-ladingen van de atomen van de moleculen in geladen atomen.
In ons geval verdeelt het water in positieve waterstof en negatieve zuurstof. Hiervoor is een grote hoeveelheid energie nodig, en om minder van de benodigde hoeveelheid energie te maken wordt een katalysator gebruikt.
Electrolyzer voor waterstofproductie
Aardingsberekening
Om de eenvoudigste elektrolyseur met uw eigen handen te monteren, kunt u de tekening in de afbeelding gebruiken.


Tekening van de eenvoudigste zelfgemaakte elektrolyseur
Notitie! Een elektrolyse-inrichting is een nogal gevaarlijke installatie, die tijdens bedrijf knalgas, dat zich in grote hoeveelheden ophoopt, een ernstige explosie kan veroorzaken. Het apparaat mag niet in de buurt van bronnen van open vuur of verwarmingsapparatuur worden geplaatst.
DIY elektrolyser voor een auto
Om de verbranding van brandstof in een automotor te verbeteren, wordt vaak een elektrolyseur gemonteerd, bestaande uit een carrosserie van een oude batterij met daarin geplaatste roestvrijstalen platen, twee spuitmonden, waarvan er één is verbonden met een tank gevuld met elektrolyt, de tweede is aangesloten op een luchttoevoerslang naar de motor (meer precies, met een golf van de luchtinlaat naar het luchtfilter).
Zo'n zelfgemaakte vloeiende elektrolyseur wordt aangedreven door de accu van de auto met behulp van een relais en een 10 A-zekering.
We maken een apparaat met onze eigen handen
Het apparaat voor dit proces kan met de hand worden gedaan.
Hiervoor heb je nodig:
- Roestvrij stalen plaat;
- Bouten M6 x 150;
- Sluitringen;
- Noten;
- Transparante buis;
- Verbindingselementen met schroefdraad aan beide zijden;
- Anderhalve liter plastic container;
- Water Filter;
- Keerklep voor water.
Een uitstekende optie voor RVS is AISI 316L van een buitenlandse fabrikant of 03X16H15M3 van een fabrikant uit ons land. Het is absoluut niet nodig om roestvrij staal aan te schaffen, u kunt de oude meenemen. 50 tot 50 centimeter is genoeg voor jou.
"Waarom zelf roestvrij staal nemen?" - je vraagt. Omdat het meest voorkomende metaal zal corroderen. Roestvrij staal verdraagt alkaliën beter. Zou moeten omlijn het vel zodanig dat het in 16 gelijke vierkanten wordt verdeeldJe kunt het snijden met een haakse slijper. Snijd in elk vierkant een van de hoeken.
Aan de andere kant en tegenoverliggende hoek, vanuit de afgezaagde hoek, boor een gat voor een bout die de platen bij elkaar houdt. De elektrolyseur stopt niet met werken als volgt:t plaatelektriciteit stroomt naar de plaat - en water valt uiteen in zuurstof en waterstof. Hierdoor hebben we een goede en een negatieve plaat nodig.
Platen moeten afwisselend worden aangesloten: plus-min-plus-min, met een vergelijkbare methode, zal er een sterke stroming zijn. Om de platen één voor één te isoleren, wordt een buis gebruikt. Een ring wordt uit het level gesneden. Door het te snijden, krijgen we een strook van millimeter dik. Deze afstand is correcter voor het maken van gas.
De platen zijn met elkaar verbonden met ringen: we plaatsen een ring op de bout, dan een plaat en drie ringen, dan weer een plaat, enzovoort. Op de plus en min moeten acht platen worden geplant. Als alles correct is gedaan, zullen de sneden van de platen de elektroden niet raken.
Dan moet je de moeren aandraaien en de platen isoleren. Vervolgens plaatsen we de structuur in een plastic container.
Overzicht van fabrikanten van elektrolyse-apparaten
De belangrijkste producenten van elektrolysers zijn zowel binnenlandse ondernemingen (RUSAL, NPF RutTech, JSC Uralkhimmash) als hun buitenlandse concurrenten - Teledyne Energy Systems, Inc (VS), Hydrogenics Corp. (België).
De elektrolyse-inrichting is dus een vrij eenvoudige en veelzijdige installatie die wordt gebruikt om knalgas te produceren, dat in de toekomst zal worden gebruikt als brandstof voor verbrandingsmotoren en verwarmingsketels.
Doe-het-zelf elektrolyse in huis
Toen ik klein was, wilde ik altijd zelf iets doen, met mijn eigen handen. Maar de ouders (en andere naaste mensen) lieten dit in de meeste gevallen niet toe. En ik zag toen (en tot nu toe zie ik niet) iets slechts als kleine kinderen willen leren ??
Natuurlijk heb ik dit artikel niet geschreven om ervaringen uit de kindertijd in herinnering te roepen in de wens om aan zelfstudie te beginnen. Gewoon per ongeluk, toen ik op internet aan het surfen was, kwam ik een dergelijke vraag tegen. Een kleine bommenwerper stelde vragen over hoe je thuis elektrolyse kunt uitvoeren. Toegegeven, ik heb hem geen antwoord gegeven, omdat deze jongen het pijnlijk verdachte mengsel wilde elektrolyseren ?? Ik besloot dat ik niet verder zou zeggen uit zonde, laat me zelf in boeken kijken. Maar nog niet zo lang geleden, opnieuw dwalend door de forums, zag ik een soortgelijke vraag van een leraar op een scheikundeschool. Afgaande op de beschrijving is zijn school zo arm dat ze geen elektrolyse-inrichting kan (wil) kopen voor 300 roebel De leraar (wat een probleem!) Kon geen uitweg vinden uit de resulterende situatie. Dus ik heb hem geholpen. Voor wie nieuwsgierig is naar dit soort zelfgemaakte producten, plaats ik dit artikel op de site.
Eigenlijk is het productieproces en het gebruik van onze zelfpallet erg primitief. Maar ik zal je eerst vertellen over veiligheid en over fabricage - in de tweede. En het punt is dat we het hebben over een demonstratie-elektrolyse-inrichting, en niet over een industriële fabriek. Dankzij dit is het voor de veiligheid goed om het niet via het netwerk van stroom te voorzien, maar van AA-batterijen of van een batterij. Hoe hoger de spanning, hoe sneller het elektrolyseproces zal verlopen. Voor visuele waarneming van gasbellen is het echter vrij genoeg 6 V, maar 220 is al overdreven. met zo'n spanning kookt water bijvoorbeeld het snelst, en dit is niet erg veilig ... Nou, ik denk dat je de spanning doorhebt?
Laten we het nu hebben over waar en onder welke omstandigheden we gaan experimenteren. Allereerst moet het een vrije ruimte of een goed geventileerde ruimte zijn. Hoewel ik alles deed in een appartement met gesloten ramen en niets leuks? Ten tweede kan het experiment het beste op een goede tafel worden gedaan. Het woord "goed" betekent dat de tafel stabiel moet zijn, en beter zwaar, stijf en vastgemaakt aan het vloeroppervlak. In dit geval moet de tafelbekleding bestand zijn tegen agressieve stoffen. Trouwens, tegels van een tegel zijn hier perfect voor (hoewel niet alle, helaas). Een tafel als deze is niet alleen handig voor deze ervaring. Ik heb echter alles op een gewone kruk gedaan ?? Ten derde hoeft u tijdens het experiment de stroombron niet te verplaatsen (in mijn geval batterijen). Daarom is het voor de betrouwbaarheid het beste om ze onmiddellijk op tafel te leggen en vast te zetten zodat ze niet wijken. Geloof me, dit is handiger dan ze regelmatig met je handen vast te houden. Ik bond gewoon mijn eigen batterijen met isolatietape vast aan het eerste harde voorwerp dat ik zag. Ten vierde, de gerechten waarin we zullen experimenteren, laten ze klein zijn. Een eenvoudig glas past of een borrelglas. Dit is overigens de meest optimale manier om een bril thuis te gebruiken, in plaats van er bij verder gebruik alcohol in te gieten ...
Laten we nu specifiek naar het apparaat kijken. Het staat in de figuur, maar voorlopig zal ik kort uitleggen wat en waarmee.
We moeten een eenvoudig potlood nemen en de boom eruit halen met een gewoon mes en een hele draad uit het potlood halen. U kunt echter een stift van een mechanisch potlood nemen. Maar er zijn twee moeilijkheden tegelijk. De eerste is de gebruikelijke. De stift van een mechanisch potlood is te dun, voor ons is dit simpelweg niet geschikt voor een visueel experiment. De tweede moeilijkheid is een onbegrijpelijke samenstelling van de huidige leien. Het voelt alsof ze niet van grafiet zijn gemaakt, maar van iets anders. Over het algemeen was mijn ervaring met zo'n "stift" helemaal niet succesvol, zelfs niet bij een spanning van 24 V. Hierdoor moest ik een goed houtachtig eenvoudig potlood uitkiezen. De resulterende grafietstaaf zal voor ons als elektrode dienen. Zoals u zich kunt voorstellen, hebben we twee elektroden nodig. Dankzij dit gaan we het tweede potlood kiezen of eenvoudig de bestaande staaf in tweeën breken. Ik heb dit echt gedaan.
Met elke draad die bij de hand komt, wikkelen we de eerste lead-elektrode (met een uiteinde van de draad), en we verbinden deze draad met de minus van de stroombron (met het andere uiteinde). Dan nemen we de tweede voorsprong en doen daarmee hetzelfde. Hiervoor hebben we op basis hiervan een tweede draad nodig. Maar in dit geval verbinden we deze draad met de plus van de voeding. Als u problemen ondervindt bij het bevestigen van de breekbare grafietstaaf aan de draad, kunt u het bij de hand liggende gereedschap gebruiken, zoals tape of ducttape. Als het niet lukte om de punt van het grafiet met de draad zelf te wikkelen en de tape of isolatietape geen goed contact opleverde, probeer dan de draad met geleidende lijm te lijmen. Als je dit niet hebt, bind dan in ieder geval de draad met een draad aan de draad. U hoeft niet bang te zijn, de draad zal niet doorbranden door een dergelijke spanning ??
Voor degenen die niets weten over batterijen en de eenvoudige regels om ze aan te sluiten, zal ik een beetje uitleggen. De vingerbatterij levert een spanning van 1,5 V. Op de foto heb ik twee vergelijkbare batterijen. Bovendien zijn ze met elkaar verbonden geleidelijk - de een na de ander, niet parallel. Bij een vergelijkbare (seriële) aansluiting wordt de uiteindelijke spanning opgeteld uit de spanning van elke batterij, dat wil zeggen, voor mij is het 1,5 + 1,5 = 3,0 V. Dit is minder dan de eerder genoemde 6 volt. Maar ik was te lui om nog een paar batterijen te kopen. Principe u en dus moet duidelijk zijn ??
Laten we beginnen met het experiment. Laten we ons bijvoorbeeld beperken tot de elektrolyse van water.Ten eerste is het erg toegankelijk (ik hoop dat de lezer van dit artikel niet in de Sahara woont), en ten tweede is het onschadelijk. Bovendien zal ik laten zien hoe je er twee uitvoert verschillende ervaring. Ik denk dat je genoeg fantasie hebt om met een heleboel vergelijkbare experimenten met andere stoffen te komen ?? Over het algemeen is kraanwater geschikt voor ons. Maar ik raad je aan om er wat meer van toe te voegen en te zouten. Een klein beetje - dit betekent een klein snuifje, niet een hele dessertlepel. Dit is belangrijk! Roer het zout goed om op te lossen. Water, dat in zuivere toestand een diëlektricum is, zal dus perfect elektriciteit geleiden. Veeg aan het begin van het experiment de tafel af van mogelijk vocht en plaats de stroombron en een glas water erop.
We laten beide elektroden, die onder spanning staan, in het water zakken. Zorg er tegelijkertijd voor dat alleen grafiet in het water wordt ondergedompeld en dat de draad zelf het water niet mag raken. Het begin van het experiment kan worden uitgesteld. Tijd hangt af van veel indicatoren: van de samenstelling van het water, de kwaliteit van de draden, de kwaliteit van het grafiet en natuurlijk de spanning van de stroombron. Het begin van mijn reactie werd een paar seconden vertraagd. Zuurstof begint te evolueren op de elektrode die was aangesloten op de plus van de batterijen. Waterstof komt vrij op de elektrode die op de min is aangesloten. Opgemerkt moet worden dat er meer waterstofbellen zijn. Zeer kleine belletjes plakken rond het deel van het grafiet dat in het water is ondergedompeld. Dan beginnen sommige bellen te drijven.
Elektrode aan het begin van het experiment. Er zijn nog geen gasbellen. Waterstofbellen gevormd op de elektrode die is verbonden met de negatieve pool van de batterijen
Welke andere experimenten zijn er mogelijk? Als je al genoeg met waterstof en zuurstof hebt gespeeld, gaan we verder met een ander experiment. Het is interessanter, vooral voor thuisonderzoekers. Het is interessant omdat het niet alleen mogelijk is om het te zien, maar ook om het te ruiken. In het verleden hebben we zuurstof en waterstof gekregen, die naar mijn mening niet erg spectaculair zijn. En in een ander experiment krijgen we twee stoffen (trouwens nuttig in het dagelijks leven). stop aan het begin van het experiment het vorige experiment en droog de elektroden. Neem nu tafelzout (dat je meestal in de keukenruimte gebruikt) en los dit op in de watermassa. In dit geval geen klein bedrag. Eigenlijk is een behoorlijke hoeveelheid zout het enige dat de tweede ervaring anders maakt dan de eerste. Na het oplossen van het zout kun je het experiment direct herhalen. Nu vindt er een andere reactie plaats. Op een goede elektrode komt nu geen zuurstof vrij, maar chloor. En aan de negatieve kant komt er ook waterstof vrij. Wat betreft het glas waarin de zoutoplossing zich bevindt, blijft natriumhydroxide erin achter na langdurige elektrolyse. Dit is de bekende bijtende soda, alkali.
Chloor, je zult het kunnen ruiken. Maar voor het beste effect raad ik aan om een spanning van minimaal 12 V te nemen. Anders voel je het aroma misschien niet. De aanwezigheid van alkali (na een zeer lange elektrolyse) in het glas kan op verschillende manieren worden gecontroleerd. De eenvoudigste en meest gewelddadige is om je hand in het glas te steken. Een etnisch voorteken zegt dat als een branderig gevoel begint, er alkali in het glas zit. Een slimmere en duidelijkere manier is de lakmoesproef. Als uw school zo arm is dat ze niet eens lakmoes kan krijgen, wordt u geholpen door handige indicatoren. Een van deze, zoals ze zeggen, kan dienen als een druppel bietensap ?? Maar het is heel goed mogelijk om gewoon een beetje vet in de oplossing te laten vallen. Voorzover ik weet, moet er verzeping plaatsvinden.
Voor de zeer nieuwsgierigen zal ik beschrijven wat er werkelijk is gebeurd tijdens de experimenten. In het eerste experiment vond onder invloed van een elektrische stroom een soortgelijke reactie plaats: 2 H2O >>> 2 H2 + O2 Beide gassen drijven van nature uit het water naar de oppervlakte. Overigens kunnen drijvende gassen worden ingevangen. Kunt u het zelf doen?
In een ander experiment was de reactie compleet anders.Het werd ook geïnitieerd door een elektrische stroom, maar nu fungeerde niet alleen water, maar ook zout als reagentia: 4H2O + 4NaCl >>> 4NaOH + 2H2 + 2Cl2 Houd er rekening mee dat de reactie moet plaatsvinden in een overmaat aan water. Om erachter te komen welke hoeveelheid zout als het grootste wordt beschouwd, kunt u het uit de bovenstaande reactie tellen. U kunt ook nadenken over hoe u het apparaat kunt verbeteren of welke andere experimenten er kunnen worden gedaan. Het is inderdaad mogelijk dat natriumhypochloriet kan worden verkregen door elektrolyse. In laboratoriumomstandigheden wordt het in de meeste gevallen verkregen door gasvormig chloor door een natriumhydroxideoplossing te leiden.