Metoder for å produsere hydrogen under industrielle forhold
Ekstraksjon ved metanomdannelse
... Vann i damptilstand, forvarmet til 1000 grader Celsius, blandes med metan under trykk og i nærvær av en katalysator. Denne metoden er interessant og bevist. Det skal også bemerkes at den stadig forbedres: søket etter nye katalysatorer, billigere og mer effektive, er i gang.
Tenk på den eldste metoden for å produsere hydrogen - kullgassifisering
... Forutsatt at det ikke er tilgang til luft og en temperatur på 1300 grader Celsius, oppvarmes kull og vanndamp. Dermed blir hydrogen fortrengt fra vann, og karbondioksid oppnås (hydrogen vil være øverst, karbondioksid, også oppnådd som et resultat av reaksjonen, er i bunnen). Dette vil være separasjonen av gassblandingen, alt er veldig enkelt.
Å skaffe hydrogen av elektrolyse av vann
regnes som det enkleste alternativet. For implementeringen er det nødvendig å helle en brusoppløsning i beholderen, og også plassere to elektriske elementer der. Den ene vil bli ladet positivt (anode) og den andre negativt (katode). Når strøm tilføres, vil hydrogen gå til katoden og oksygen til anoden.
Å skaffe hydrogen etter metoden delvis oksidasjon
... For dette brukes en legering av aluminium og gallium. Den plasseres i vann, noe som fører til dannelse av hydrogen og aluminiumoksyd under reaksjonen. Gallium er nødvendig for at reaksjonen skal skje i sin helhet (dette elementet vil forhindre at aluminium oksiderer for tidlig).
Nylig ervervet relevans metode for bruk av bioteknologi
: under betingelse av mangel på oksygen og svovel, begynner klamydomonas å frigjøre hydrogen intensivt. En veldig interessant effekt som nå studeres aktivt.

Ikke glem en annen gammel, velprøvd metode for hydrogenproduksjon, som består i å bruke forskjellige alkaliske elementer
og vann. I prinsippet er denne teknikken mulig i laboratorieinnstillinger med nødvendige sikkerhetstiltak på plass. I løpet av reaksjonen (det fortsetter med oppvarming og med katalysatorer) dannes således et metalloksyd og hydrogen. Det gjenstår bare å samle det.
Få hydrogen forbi interaksjon mellom vann og karbonmonoksid
bare mulig i et industrielt miljø. Karbondioksid og hydrogen dannes, prinsippet om separasjon er beskrevet ovenfor.

Omfanget av hydrogengeneratoren
H2 er en moderne energibærer som brukes aktivt i mange industriområder. Her er bare noen få:
- produksjon av hydrogenklorid (HC) l;
- produksjon av drivstoff til rakettkastere;
- produksjon av ammoniakk;
- bearbeiding og skjæring av metall;
- utvikling av gjødsel for sommerhytter;
- syntese av salpetersyre;
- etablering av metylalkohol;
- mat industri;
- saltsyreproduksjon;
- oppretting av varme gulvsystemer.
I tillegg har HHO blitt veldig nyttig i hverdagen, om enn med forbehold. Først og fremst brukes den til autonome varmesystemer. I tillegg tilsettes Browns gass til bensin i et forsøk på å lure motoren og spare på drivstoff.
Begge tilfeller har sine egne særegenheter. Så når du organiserer oppvarming av hjemmet, må du ta i betraktning at forbrenningstemperaturen til HHO er en størrelsesorden høyere enn den for metan. I denne forbindelse er det nødvendig å kjøpe en spesiell, kostbar kjele med en varmebestandig dyse. Ellers vil eieren og hans hjem være i betydelig fare.
OPPFINNINGEN HAR FØLGENDE FORDELER
Varmen som oppnås ved oksidering av gasser kan brukes direkte på stedet, og hydrogen og oksygen oppnås ved avhending av avfallsdamp og prosessvann.
Lavt vannforbruk ved generering av strøm og varme.
Enkelheten i veien.
Betydelige energibesparelser som den brukes bare på å varme opp starteren til det etablerte termiske regimet.
Høy produktivitet i prosessen, fordi dissosiasjon av vannmolekyler varer tiendedeler av et sekund.
Eksplosjon og brannsikkerhet av metoden, fordi i implementeringen er det ikke behov for beholdere for å samle hydrogen og oksygen.
Under driften av installasjonen blir vann gjentatte ganger renset og omdannet til destillert vann. Dette eliminerer sedimenter og kalk, noe som øker installasjonens levetid.
Installasjonen er laget av vanlig stål; unntatt kjeler laget av varmebestandig stål med foring og skjerming av veggene. Det vil si at det ikke kreves spesielle dyre materialer.
Oppfinnelsen kan finne anvendelse i
industrien ved å erstatte hydrokarbon og kjernefysisk drivstoff i kraftverk med billig, utbredt og miljøvennlig vann, samtidig som kraften til disse anleggene opprettholdes.
Hydrogen hjemme: er det en fordel
Vi merker med en gang: det er ulønnsomt å bruke en hydrogengenerator til å varme opp et hus. Du vil bruke mer strøm på å produsere ren H2 enn du vil motta energi etter at du har brent den. Så, for 1 kW varme blir 2 kW strøm brukt, det vil si at det ikke er noen fordel. Det er lettere å installere noen av de elektriske kjelene hjemme.
For å erstatte 1 liter bensin til en bil, trenger du 4766 liter rent hydrogen eller 7150 liter oksyhydrogengass, hvorav 1/3 er oksygen. Så langt har ikke selv de beste hodene i verden utviklet en enhet som er i stand til å levere en slik ytelse.


KRAV
Metode for å produsere hydrogen og oksygen fra vanndamp
, inkludert å føre denne dampen gjennom et elektrisk felt, karakterisert ved at de bruker overopphetet damp av vann med en temperatur
500 - 550 o C
, ledet gjennom et høyspennings elektrisk strømfelt for å dissosiere damp og skille det i hydrogen- og oksygenatomer.
Jeg har lenge ønsket å gjøre en lignende ting. Men ytterligere eksperimenter med et batteri og et par elektroder nådde ikke. Jeg ønsket å lage et fullverdig apparat for produksjon av hydrogen, i mengder for å blåse opp en ballong. Før jeg laget et fullverdig apparat for elektrolyse av vann hjemme, bestemte jeg meg for å sjekke alt på modellen.
Den generelle ordningen til elektrolysatoren ser slik ut.
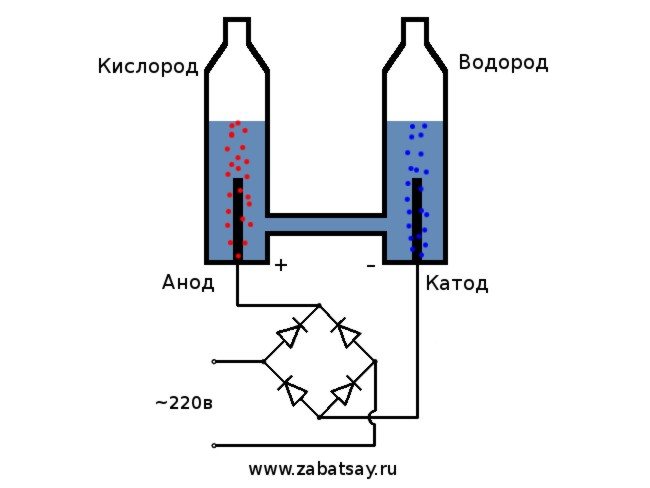

Denne modellen er ikke egnet for full daglig bruk. Men vi klarte å teste ideen.
Så jeg bestemte meg for å bruke grafitt til elektrodene. En utmerket kilde til grafitt for elektroder er trolleybussoppsamleren. Det er mange av dem som ligger rundt ved endestoppene. Det må huskes at en av elektrodene vil kollapse.


Vi så og avsluttet med en fil. Intensiteten av elektrolyse avhenger av styrken på strømmen og området til elektrodene.


Ledninger er festet til elektrodene. Ledningene må være nøye isolert.


For elektrolysermodellen er plastflasker ganske passende. Hull er laget i dekselet for rør og ledninger.


Alt er grundig belagt med tetningsmiddel.


Avskårne flaskehalser er egnet for tilkobling av to beholdere.


De må settes sammen og sømmen må smeltes.


Nøttene er laget av flaskehetter.


Hullene er laget i to flasker nederst. Alt er koblet sammen og nøye fylt med fugemasse.


Vi vil bruke et 220V husholdningsnett som en spenningskilde. Jeg vil advare deg om at dette er et ganske farlig leketøy. Så hvis du ikke har tilstrekkelige ferdigheter eller det er tvil, er det bedre å ikke gjenta.I husholdningsnettverket har vi vekselstrøm, for elektrolyse må den rettes ut. En diodebro er perfekt for dette. Den på bildet var ikke kraftig nok og brant raskt ut. Det beste alternativet var den kinesiske MB156-diodebroen i en aluminiumsveske.


Diodebroen blir veldig varm. Aktiv kjøling vil være nødvendig. En kjøler for en dataprosessor er perfekt. En koblingsboks av passende størrelse kan brukes til kapslingen. Selges i elektriske varer.


Flere lag papp må plasseres under diodebroen.


De nødvendige hullene er laget i lokket på koblingsboksen.


Slik ser den monterte enheten ut. Elektrolysatoren får strøm fra strømnettet, viften drives av en universell strømkilde. En natronoppløsning brukes som elektrolytt. Her må man huske at jo høyere konsentrasjonen av løsningen, jo høyere reaksjonshastighet. Men samtidig er oppvarmingen også høyere. Videre vil reaksjonen av natriumnedbrytning ved katoden bidra til oppvarmingen. Denne reaksjonen er eksoterm. Som et resultat vil hydrogen og natriumhydroksid bli dannet.


Enheten på bildet over var veldig varm. Den måtte skrus av med jevne mellomrom og vent til den avkjøles. Oppvarmingsproblemet ble delvis løst ved avkjøling av elektrolytten. Til dette brukte jeg en fontene pumpe på bordet. Et langt rør går fra en flaske til en annen gjennom en pumpe og en bøtte med kaldt vann.


Relevansen av dette problemet i dag er ganske høy på grunn av at det å bruke hydrogen er ekstremt omfattende, og i sin rene form finnes det praktisk talt ikke noe sted i naturen. Det er derfor det er utviklet flere teknikker som tillater utvinning av denne gassen fra andre forbindelser gjennom kjemiske og fysiske reaksjoner. Dette er diskutert i artikkelen ovenfor.
Å skaffe hydrogen og sjekke det for renhet
Hydrogen kan oppnås ved å omsette sink og saltsyre.
Zn + 2HCl = ZnCl2 + H2 ↑
Sink fortrenger hydrogen fra syrer, som alle metaller som står i spenningsserien til venstre for hydrogen.
For å samle hydrogen i et prøverør, må du snu det på hodet, fordi hydrogen er lettere enn luft og har en tendens oppover. Denne metoden for å samle hydrogen kalles "metoden for luftforskyvning."
Fig. 1. Å skaffe hydrogen og samle det opp ved luftforskyvning
Reagensrøret akkumulerer hydrogen, men det inneholder også luft, og derfor oksygen. Hydrogen og oksygen er eksplosive blandinger. Vi antenner det oppsamlede hydrogenet med en splint. Reagensrøret er lite, og eksplosjonen av hydrogen og oksygen er bare et skarpt smell. Jo mindre oksygen i blandingen, jo roligere bomull.
Hvis hydrogenet som er samlet i reagensrøret er rent, vil vi høre en kjedelig pop. Slike hydrogen kan antennes.
Husholdningens hydrogenproduksjon
Valg av elektrolysator
For å skaffe et element av huset trenger du et spesielt apparat - en elektrolysør. Det er mange alternativer for slikt utstyr på markedet; enhetene tilbys av både kjente teknologiselskaper og små produsenter. Merkede enheter er dyrere, men byggekvaliteten er høyere.
Husholdningsapparatet er lite og enkelt å bruke. Hoveddetaljene er:

Elektrolysator - hva er det?
- reformator;
- rengjøringssystem;
- brenselsceller;
- kompressor utstyr;
- en beholder for lagring av hydrogen.
Enkelt vann fra springen tas som råvare, og strøm kommer fra et vanlig uttak. Soldrevne enheter sparer strøm.
Hjemhydrogen brukes i varme- eller kokesystemer. Og de beriker drivstoff-luft-blandingen for å øke kraften til bilens motorer.
Å lage et apparat med egne hender
Det er enda billigere å lage enheten selv hjemme.En tørr celle ser ut som en forseglet beholder, som består av to elektrodeplater i en beholder med en elektrolytisk løsning. World Wide Web tilbyr en rekke monteringsskjemaer for enheter av forskjellige modeller:
- med to filtre;
- med topp eller bunn arrangement av beholderen;
- med to eller tre ventiler;
- med galvanisert brett;
- på elektrodene.

Elektrolyseenhetsdiagram
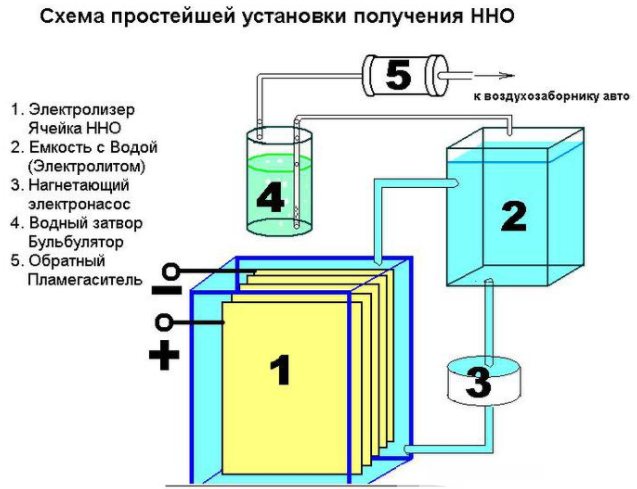
Det er ikke vanskelig å lage en enkel enhet for å produsere hydrogen. Det vil kreve:
- rustfritt stål ark;
- gjennomsiktig rør;
- tilbehør;
- plastbeholder (1,5 l);
- vannfilter og kontraventil.

Enheten til en enkel enhet for å produsere hydrogen
I tillegg vil forskjellige maskinvarer være nødvendige: muttere, skiver, bolter. Det første trinnet er å kutte arket i 16 firkantede rom, kutte et hjørne fra hver av dem. I det motsatte hjørnet fra det, må du bore et hull for å bolte platene. For å sikre konstant strøm, må platene kobles i henhold til pluss - minus - pluss - minus ordningen. Disse delene er isolert fra hverandre med et rør, og ved forbindelsen med en bolt og skiver (tre stykker mellom platene). 8 plater er plassert på pluss og minus.
Når de er riktig montert, vil ikke ribben på platene ikke berøre elektrodene. De monterte delene senkes ned i en plastbeholder. På det punktet hvor veggene berører, er to monteringshull laget med bolter. Installer en sikkerhetsventil for å fjerne overflødig gass. Beslag er montert i beholderlokket og sømmene er forseglet med silikon.
Testing av apparatet
For å teste enheten, utfør flere handlinger:

Hydrogenproduksjon
- Fyll på væske.
- Dekk til med et lokk, koble den ene enden av røret til beslaget.
- Den andre er nedsenket i vann.
- Koble til en strømkilde.
Etter å ha koblet enheten til et stikkontakt, etter noen sekunder, vil elektrolyseprosessen og nedbør være merkbar.
Rent vann har ikke god elektrisk ledningsevne. For å forbedre denne indikatoren, må du lage en elektrolytisk løsning ved å tilsette et alkali-natriumhydroksid. Det finnes i rørrensingsforbindelser som føflekken.
Metoder for å produsere hydrogen
Hydrogen er et fargeløst og luktfritt gasselement med en tetthet på 1/14 i forhold til luft. I en fri stat er det sjelden. Vanligvis kombineres hydrogen med andre kjemiske elementer: oksygen, karbon.
Hydrogenproduksjon for industrielle behov og kraftteknikk utføres på flere måter. De mest populære er:
- elektrolyse av vann;
- konsentrasjonsmetode;
- lav temperatur kondens;
- adsorpsjon.
Hydrogen kan isoleres ikke bare fra gassformige eller vannforbindelser. Hydrogen produseres ved å utsette tre og kull for høye temperaturer, samt ved å behandle bioavfall.
Atomisk hydrogen for kraftteknikk oppnås ved hjelp av metoden for termisk dissosiasjon av et molekylært stoff på en ledning laget av platina, wolfram eller palladium. Den varmes opp i en hydrogenatmosfære under et trykk på mindre enn 1,33 Pa. Og også radioaktive elementer brukes til å produsere hydrogen.
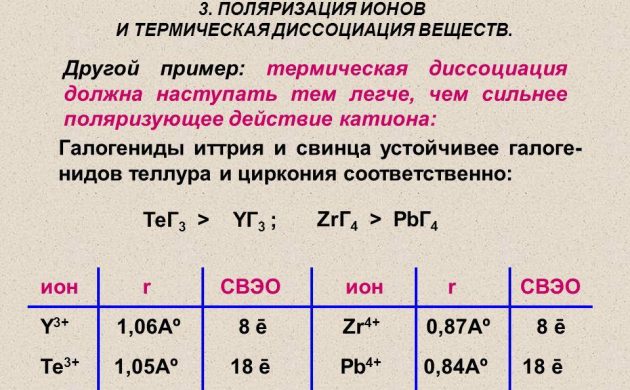

Termisk dissosiasjon
Elektrolysemetode
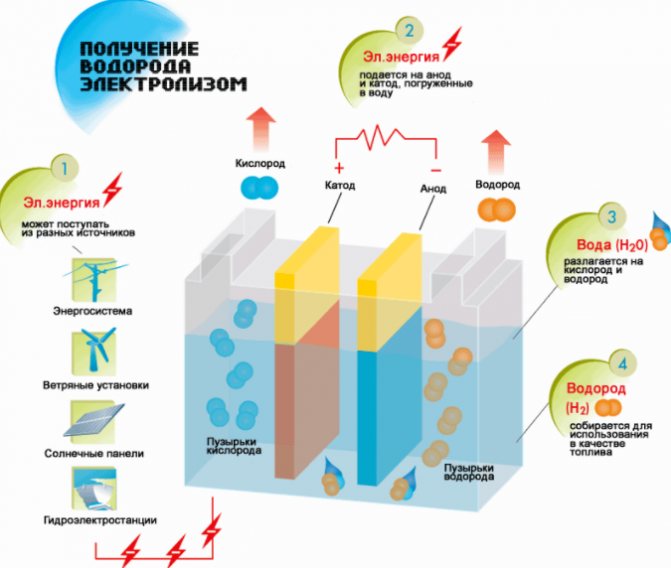
Den enkleste og mest populære metoden for hydrogenutvikling er vannelektrolyse. Det tillater produksjon av praktisk talt rent hydrogen. Andre fordeler med denne metoden er:
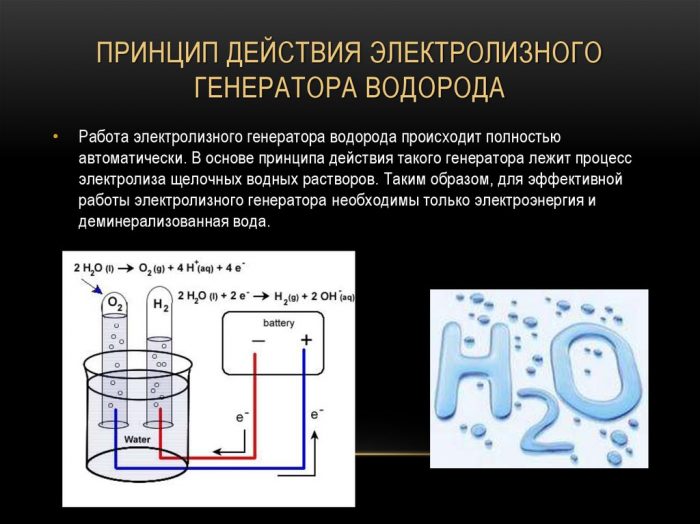

Prinsippet om drift av elektrolysehydrogengeneratoren
- tilgjengeligheten av råvarer;
- motta et element under trykk;
- evnen til å automatisere prosessen på grunn av mangel på bevegelige deler.
Fremgangsmåten for å dele en væske ved elektrolyse er omvendt av forbrenningen av hydrogen. Essensen er at under påvirkning av likestrøm frigjøres oksygen og hydrogen på elektrodene dyppet i en vandig elektrolyttoppløsning.
En ekstra fordel anses å være produksjonen av biprodukter med industriell verdi.Dermed er det nødvendig med en stor mengde oksygen for å katalysere teknologiske prosesser i energisektoren, rydde opp i jord og vannforekomster og avhende husholdningsavfall. Tungt vann oppnådd under elektrolyse brukes i kraftteknikk i atomreaktorer.
Hydrogenproduksjon etter konsentrasjon
Denne metoden er basert på separasjonen av et element fra gassblandinger som inneholder det. Dermed blir den største delen av det industrielt produserte stoffet ekstrahert ved hjelp av dampreformering av metan. Hydrogen ekstrahert i denne prosessen brukes i energi, oljeraffinering, rakettbyggende næringer, samt til produksjon av nitrogengjødsel. Prosessen med å skaffe H2 utføres på forskjellige måter:
- kort syklus;
- kryogenisk;
- membran.
Sistnevnte metode anses som den mest effektive og billigere.
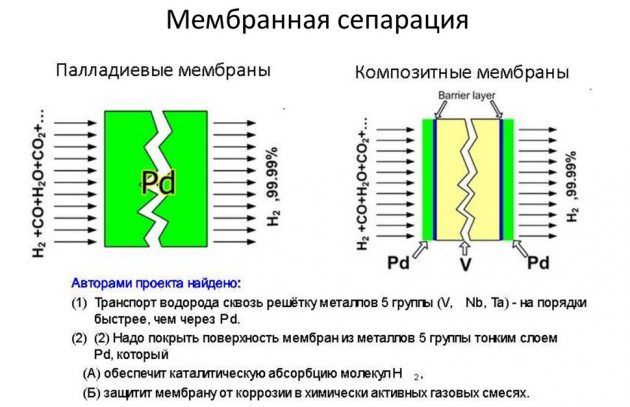

Kondens ved lav temperatur
Denne metoden for å oppnå H2 består i sterk avkjøling av gassformige forbindelser under trykk. Som et resultat blir de forvandlet til et tofasesystem, som deretter skilles fra en separator til en flytende komponent og en gass. Flytende medier brukes til kjøling:
- vann;
- flytende etan eller propan;
- flytende ammoniakk.


Denne prosedyren er ikke så lett som det høres ut. Det vil ikke være mulig å skille hydrokarbongasser rent på en gang. Noen av komponentene vil komme igjen med gass fra separasjonsrommet, noe som ikke er økonomisk. Problemet kan løses ved dyp avkjøling av råmaterialet før separering. Men dette krever mye energi.
I moderne kondensatorsystemer med lav temperatur er det i tillegg gitt demetanisering eller avetaniseringskolonner. Gassfasen fjernes fra det siste separasjonstrinnet, og væsken sendes til destillasjonskolonnen med en strøm av rå gass etter varmeveksling.
Adsorpsjonsmetode
Under adsorpsjon, for å frigjøre hydrogen, brukes adsorbenter - faste stoffer som absorberer de nødvendige komponentene i gassblandingen. Aktivt karbon, silikatgel, zeolitter brukes som adsorbenter. For å utføre denne prosessen brukes spesielle enheter - sykliske adsorbere eller molekylsikter. Når den er implementert under trykk, kan denne metoden utvinne 85% hydrogen.
Hvis vi sammenligner adsorpsjon med kondensasjon ved lave temperaturer, kan vi merke en lavere material- og driftskostnad for prosessen - i gjennomsnitt med 30 prosent. Hydrogen produseres ved adsorpsjon for kraftteknikk og ved bruk av løsningsmidler. Denne metoden tillater ekstraksjon av 90 prosent H2 fra gassblandingen og oppnå sluttproduktet med en hydrogenkonsentrasjon på opptil 99,9%.